Rôle des génotoxines produites par des bactéries du microbiote dans le cancer colorectal
-
Upload
jean-philippe -
Category
Documents
-
view
222 -
download
4
Transcript of Rôle des génotoxines produites par des bactéries du microbiote dans le cancer colorectal

AGENTS INFECTIEUX ET CANCERS
REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456 // 77
article reçu le 7 juin, accepté le 10 juin 2013.
© 2013 – Elsevier Masson SAS – Tous droits réservés.
SUMMARYRole of genotoxic bacteria in colorectal cancer
Numerous studies support a role for the intestinal microbiota in colorectal tumorigenesis. Recent results have suggested that bacteria of the microbiota could be associated with the presence of tumours. Some can be directly genotoxic : as we showed, strains of Escherichia coli, an ubiquitous member of the colon flora, synthesize a genotoxin called colibactin. These bacteria induce DNA double strand breaks in intestinal cells and trigger chromosomal instability, gene mutations and cell transformation. Moreover it was recently shown that colibactin-producing E. coli promote colorectal cancer in a murine IL10-/- model. Thus long-term colonization of the colon with rogue commensal bacteria capable of causing chronic DNA-damage could contribute to sporadic colorectal cancer development.
Colorectal tumors – Escherichia coli.
RÉSUMÉDe récents travaux suggèrent que le microbiote intestinal pourrait jouer un rôle important dans la carcinogenèse colorectale. Des études ont mis en évidence que des bactéries commensales du microbiote pouvaient être associées à la présence de tumeurs. Certaines peuvent être directement génotoxiques : c’est le cas de Escherichia coli, une des bactéries ubiqui-taires anaérobies facultatives prédominantes de la flore du côlon. Nous avons ainsi découvert que certaines souches de E. coli synthétisent une génotoxine, la colibactine. Ces souches induisent des cassures double brin de l’ADN des cellules de la muqueuse intestinale et déclenchent une instabilité chromosomique, des mutations géniques et la transformation cellulaire, moteurs fondamentaux de la carcinogenèse. Il a été démontré récemment que ces E. coli produisant la colibactine ont un effet promoteur dans un modèle murin IL10-/- de cancérogenèse colorectale. La présence dans le microbiote intestinal de souches bactériennes qui produisent des toxines lésant l’ADN des cellules de l’hôte pourrait donc constituer un facteur prédisposant au développement de la forme sporadique du cancer colorectal.
Tumeurs colorectales – Escherichia coli.
Claude Petita, Eric Oswaldb,c, Jean-Philippe Nougayredec,*
Rôle des génotoxines produites par des bactéries du microbiote dans le cancer colorectal
1. Introduction
Avec chaque année en France 40 000 nouveaux cas et 16 500 décès, le cancer colorectal est au troisième rang de l’ensemble des cancers incidents. Bien que les progrès dans la détection de la maladie avec un diagnostic plus précoce et l’amélioration de la prise en charge thérapeutique permettent actuellement de réduire la mortalité (- 21 % en 20 ans), le cancer colorec-tal reste au deuxième rang des décès par cancer derrière le
a INRA USC 1360 – INP-Ecole nationale vétérinaire23, chemin des Capelles – B.P. 8761431076 Toulouse cedex 3 b Laboratoire de bactériologie-hygièneCentre hospitalier universitaire de Toulouse-PurpanPlace du Docteur-Baylac – B.P. 302831024 Toulouse cedex 03 c INRA USC 1360 – Inserm UMR 1043 Centre de physiopathologieCentre hospitalier universitaire de Toulouse-PurpanPlace du Docteur-Baylac – B.P. 302831024 Toulouse cedex 03
cancer du poumon [1]. Le cancer colorectal est une maladie multifactorielle sous la dépendance de facteurs environ-nementaux et génétiques. Il peut être classé par étiologie comme héréditaire (par exemple la polypose adénomateuse familiale due à une mutation initiatrice dans le gène APC), inflammatoire (associée notamment à la maladie de Crohn et la colite ulcérative) ou le plus souvent sporadique (dans plus de 80 % des cas). Le développement du cancer du côlon procède par étapes cliniques séquentielles, de la cellule épithéliale saine à l’adénome jusqu’au carcinome invasif. Dans ce processus se déroulant sur une durée estimée à 11-27 années, les cellules accumulent les altérations géné-tiques motrices. Dans ce modèle, le processus est initié par une mutation inactivant la voie APC/β-catenine, puis des vagues d’expansion clonale successive sont rendues possibles par des mutations dans les voies KRAS/BRAF puis TGF-β, PIK3CA et p53 [2, 3]. Ces altérations géniques sont sous-tendues par des mécanismes d’instabilité des microsatellites, épigénétiques et, dans plus de 80 % des cancers colorectaux sporadiques, d’instabilité chromosomique [4].Des facteurs de risque du cancer colorectal ont été identi-fiés. Outre l’hérédité familiale et l’âge, la consommation d’al-cool, le tabagisme, l’activité physique et l’index de masse corporelle sont impliqués. Le régime alimentaire représente le facteur de risque le plus significatif dans 80 % des cas [5]. Ce cancer montre des variations marquées dans sa dis-tribution géographique, avec une prévalence plus élevée

78 // REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456
dans les pays dits développés (hormis le Japon), indiquant l’importance des facteurs environnementaux. En effet, les immigrants depuis des zones à basse incidence acquièrent la même incidence que celle des populations locales, et les habitudes alimentaires sont particulièrement importantes dans cet aspect. Or, le régime alimentaire peut modifier la composition de la microflore intestinale (microbiote) et, réciproquement, l’activité métabolique des bactéries intestinales peut générer ou convertir des carcinogènes, suggérant donc une implication du microbiote dans l’étio-logie de ce cancer [6-9].
2. Le microbiote intestinal dans
la genèse du cancer colorectal
On peut noter que l’augmentation de la densité bactérienne dans la lumière intestinale du gros intestin (1012 bactéries/g) par rapport à l’intestin grêle (102 bactéries/g) corrèle avec l’augmentation massive du risque de cancer dans ces parties respectives du tube digestif. De nombreuses études soutiennent maintenant la notion que le micro-biote intestinal serait un facteur environnemental majeur pouvant moduler le risque de cancer colorectal [9-14]. Ainsi, on observe dans des modèles de cancers colorec-taux chez des souris génétiquement modifiées, ou chez des rongeurs traités avec des initiateurs chimiques que ces animaux sont prédisposés au développement d’un cancer colorectal en présence d’une flore intestinale, mais pas quand ils sont élevés en conditions stériles (tableau I). Les études épidémiologiques cherchant à corréler la présence d’espèces bactériennes spécifiques avec l’incidence du cancer n’ont pas encore révélé à ce jour de signature claire dans le microbiote de populations à risque, ou chez les patients atteints de cancer du côlon [15-18]. Ces approches sont en effet compliquées par l’énorme complexité du microbiote intestinal (compre-nant plus de 1 500 espèces bactériennes différentes, avec une diversité propre à chaque individu) [19], par les variations génomiques entre les différentes souches bactériennes d’une même espèce, ainsi que par le temps de latence entre l’initiation de la maladie et le cancer. Cependant, plusieurs études suggèrent dès à présent que certaines souches bactériennes toxigéniques ou colitogènes pourraient jouer un rôle dans l’étiologie du cancer colorectal.
2.1. Un rôle des bactéries toxigéniques et colitogènesLe lien entre inflammation chronique, en particulier les maladies inflammatoires du tractus digestif, et la carcino-genèse est maintenant bien établi [11, 20]. Ainsi certaines souches commensales de Bacteroides fragilis pouvant coloniser le tractus intestinal de façon asymptomatique (chez 4 à 30 % des individus) sont toxigéniques, produi-sant la toxine « BFT » [21]. BFT est une métalloprotéase, qui induit indirectement le clivage de la E-cadherine, avec pour conséquence l’augmentation de la perméabilité et l’exposition de la sous-muqueuse aux antigènes bactériens de la lumière intestinale, contribuant ainsi à une inflam-mation chronique. Le clivage de la E-cadhérine stimule aussi la voie β-caténine/Wnt et l’augmentation de la pro-lifération cellulaire, ainsi que la sécrétion de cytokines pro-inflammatoires [14]. Dans le modèle de souris Min mutées sur le gène APC, les animaux colonisés par une souche de B. fragilis BFT+ (mais pas par une souche BFT-) développent une colite inflammatoire de type Th17, une hyperplasie et de nombreuses tumeurs coliques, qui sont diminuées par traitement avec des anticorps anti-IL17 [22]. Ces souches de B. fragilis toxigéniques apparaissent donc comme des « pathobiontes » (membres agressifs parmi les commensales) contribuant à l’inflammation et la carcinogenèse colique.Outre B. fragilis, d’autres souches bactériennes colito-gènes ont été notées comme promotrices de tumeurs dans des modèles murins [23, 24]. Notamment, des souris KO IL-10 mono-colonisées avec la bactérie commensale intestinale Enterococcus faecalis développent une colite distale sévère et des carcinomes [25]. E. faecalis produit des espèces réactives de l’oxygène (ROS) [26] qui induisent dans les cellules intestinales un stress oxydatif ainsi que la surexpression de la cyclooxygénase-2 [27], tous deux impliqués dans la carcinogenèse [28, 29]. De plus, les ROS produites par E. faecalis induisent des lésions à l’ADN des cellules, ainsi qu’une instabilité chromosomique [27, 30]. Des études ont montré des dommages à l’ADN des cel-lules intestinales accrus chez les patients atteints de colite ulcérative [31]. Des souris mutées pour les enzymes qui réduisent les péroxides (Gpx1-2) développent une colite et des tumeurs quand ils sont élevés en présence d’une flore intestinale, mais pas en condition stérile [32]. Il apparaît donc que le stress oxydatif induit par E. faecalis partici-perait à la tumorigenèse colorectale.Récemment, nous avons fourni un argument supplémentaire en faveur d’un rôle de bactéries génotoxiques dans l’étio-logie du cancer colorectal en démontrant que des souches de Escherichia coli induisent des cassures double-brin de l’ADN des entérocytes et déclenchent une instabilité chromosomique avec l’accumulation de mutations et la transformation des cellules.
2.2. Des Escherichia coli génotoxiques dans le microbiote intestinalE. coli est une bactérie commensale du microbiote intes-tinal de l’Homme et des animaux. E. coli s’établit dans le tractus digestif dès les premiers jours après la nais-sance, puis demeure tout au long de la vie de l’hôte l’es-pèce bactérienne dominante de la microflore anaérobie
Tableau I – Effets du microbiote intestinal sur le
développement du cancer colorectal dans des modèles
de rongeurs chimio-induits ou génétiquement modifiés.
Chimio-inducteur ou gène
Incidence (adéno)carcinome
(%) Références
Conventionnel Axénique
TCRβ/p53 70 0 [46]
IL-10 7 0 [47]
Gpx1/Gpx2 25 0 [32]
1,2-diméthylhydrazine (DMH) 17 0 [48]
Azoxymethane(AOM) + bile
78 50 [49]

AGENTS INFECTIEUX ET CANCERS
REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456 // 79
facultative du côlon. Cependant, E. coli est aussi un patho-gène majeur, impliqué dans des infections très variées. Des souches spécialisées de E. coli sont en effet responsables de diarrhées, de toxi-infections alimentaires, d’infections urinaires, de bactériémies et de méningites [33]. La diver-sité de la population de E. coli s’observe en premier lieu par une organisation de l’espèce en plusieurs groupes phylogénétiques majeurs (A, B1, B2, D, E…) [34] mais il faut avant tout prendre en compte le fait que E. coli n’est pas une espèce homogène. Ce taxon présente en effet une diversité, un potentiel évolutif et un pouvoir patho-gène considérables. Les souches de E. coli pathogènes n’ont qu’environ 40 % de leur génome en commun avec celui de souches commensales, et l’on retrouve la même variabilité entre les génomes des différentes souches pathogènes. Ces souches ont en effet acquis au cours de l’évolution un répertoire de gènes de virulence, portés par des éléments génétiques mobiles (plasmides, phages, îlots génomiques) [35], qui leur permettent de coloniser de nouvelles niches écologiques en piratant les mécanismes de défense de l’hôte.
2.3. La colibactine, une génotoxine bactérienneEn 2006, nous avons identifié chez des souches de E. coli isolées d’infections extra-intestinales une nouvelle toxine,
la « colibactine » [36]. Son déterminant génétique est un îlot génomique de 54 kb, appelé « îlot pks », qui porte des gènes codant pour des polykétides synthases (PKS) et des peptides synthases non-ribosomiques (NRPS). Les NRPS et PKS sont des enzymes qui synthétisent des métabolites secondaires non-protéiques, des peptides non-ribosomaux et des polykétides. Ces composés, produits par des bac-téries et par de nombreux champignons, constituent une grande famille de produits naturels possédant une large gamme d’activités biologiques, utilisés en thérapeutique humaine et vétérinaire. Cette famille comprend notam-ment des antibiotiques (par exemple les pénicillines, la vancomycine, l’érythromycine), des immunosuppresseurs (cyclosporine) et des anti-tumoraux (bléomycine). Les enzymes codées par l’îlot pks permettent donc la syn-thèse d’un composé hybride polykétide-peptide appelé colibactine. Une infection de quelques heures de cellules eucaryotes en culture avec des E. coli hébergeant l’îlot pks provoque des cassures double-brin de l’ADN cellulaire [36]. Ces dommages intenses activent la kinase ATM qui régit la réponse cellulaire aux dommages à l’ADN, pour aboutir à l’arrêt du cycle cellulaire et, à forte dose, la mort par apoptose (figure 1).Nous avons récemment montré que la colibactine est produite in vivo dans la lumière intestinale, et induit des dommages à l’ADN des entérocytes similaires à ceux
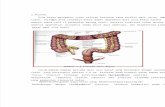
Figure 1 – Réponse cellulaire aux cassures double-brin de l’ADN induites par la colibactine.
Les E. coli portant l’îlot pks de synthèse du peptide-polyketide colibactine induisent chez les cellules eucaryotes infectées des cassures double brin de l’ADN. Les cellules activent la voie de réponse aux dommages à l’ADN, avec en premier lieu le recrutement d’ATM, aboutissant à l’arrêt du cycle cellulaire, la mise en place des systèmes de réparation et la mort cellulaire programmée (apoptose). La réparation est cruciale pour le maintien de l’intégrité du génome : incorrectement réparées, les lésions à l’ADN peuvent engendrer une instabilité chromosomique (taux accru d’aberrations des chromosomes) et l’accumulation de mutations géniques, moteurs fondamentaux dans la progression cancéreuse.

80 // REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456
induits par une irradiation de rayons ionisants gamma [37]. De plus, des infections in vitro indiquent qu’à faible dose la colibactine induit une instabilité chromosomique persistante. Les cellules montrent en effet des altérations structurelles des chromosomes (translocations, chromo-somes dicentriques en anneaux) ainsi que numériques (aneuploïdie et tétraploïdie). De plus, l’infection à faible dose induit des mutations géniques et la transforma-tion cellulaire. Ces phénomènes découlent des lésions à l’ADN induites par la colibactine qui sont incorrectement réparées par les cellules, ce qui conduit à des aberrations mitotiques, en particulier des fusions illégitimes de chro-mosomes avec pontage durant l’anaphase. Les cycles de cassure-fusion-pontage qui s’ensuivent entretiennent à long terme l’instabilité chromosomique et l’accumulation des mutations géniques. La colibactine est donc produite in vivo, induit des dommages à l’ADN des entérocytes, et déclenche une instabilité génomique pouvant conduire à la transformation cellulaire.
2.4. De nombreuses souches commensales de E. coli produisent la colibactineL’examen de la distribution de l’îlot pks codant pour la colibactine indique qu’il n’est pas restreint aux souches de E. coli pathogènes responsables des infections extra-intes-tinales, mais aussi largement distribué chez des souches dites commensales, isolées des selles d’individus sains. Dans quatre études épidémiologiques récentes, 12 à 34 % des isolats fécaux étaient positifs pour l’îlot pks [36, 38-40]. L’îlot pks et l’activité génotoxique associée sont même présents chez la souche probiotique Nissle 1917 qui est utilisée en Allemagne sous le nom de Mutaflor pour traiter la colite ulcérative pendant la phase de rémission [36]. L’îlot pks est présent presque exclusivement dans des souches appartenant au groupe phylogénétique B2. Or la proportion dans le microbiote intestinal humain des souches de E. coli du groupe B2 est en constante aug-mentation en Europe, au Japon et au États-Unis depuis ces 20 dernières années. Ce groupe phylogénétique est maintenant prévalent dans nos régions tempérées [41, 42]. Les souches de E. coli du groupe B2 sont d’excellents colonisateurs et elles peuvent persister plus durablement dans le côlon que d’autres souches de E. coli. Cette prédominance du groupe B2 s’observe même dès la naissance puisque plus de 50 % des souches de E. coli isolées à partir de selles d’enfants sont des B2 [43, 44]. Récemment, l’analyse du microbiote de 13 Japonais en bonne santé montre que les gènes codant pour la coli-bactine sont présents dans près de 40 % des selles des individus étudiés et plus particulièrement chez les nour-rissons et jeunes enfants (analyse des données de [45]). Il apparaît donc que les E. coli B2 qui produisent la coli-bactine sont fortement prévalentes et ont la capacité de coloniser l’Homme dès la naissance puis de se maintenir durablement dans le côlon.L’ensemble de ces données suggère que la présence dans la microflore intestinale de souches de E. coli génotoxiques pourrait constituer un facteur prédisposant au développe-ment de certains cancers colorectaux. Ces pathobiontes pourraient induire des effets délétères de façon chronique et répétée, à la faveur de la colonisation au long terme,
peut-être même dès la naissance. Les cassures double brin de l’ADN induites par la colibactine sont des lésions particulièrement dangereuses pour les cellules, car elles peuvent générer des mutations par réarrangements géné-tiques et des aberrations chromosomiques, causes fon-damentales de la transformation néoplasique.
2.5. Les résultats les plus récents confortent la possibilité d’un rôle du microbiote, en particulier de E. coli producteur de colibactine, dans la cancérogenèse colorectaleBien que de véritables études épidémiologiques restent encore à conduire, des travaux publiés en 2012 et 2013 viennent étayer l’hypothèse d’un rôle du microbiote dans la cancérogenèse colique. Des éléments convergents sug-gèrent ainsi que des altérations précoces de l’homéostasie du microbiote chez le nouveau-né pourraient déclencher des signaux immunitaires aberrants contribuant au déve-loppement ultérieur d’inflammation et de cancer [50]. Le rôle de l’inflammation dans le déclenchement d’une activité pro-cancérogène du microbiote se précise [51]. Ainsi, durant le processus inflammatoire, la production de nitrates dans le tractus digestif induit une dysbiose qui favorise la croissance de E. coli [52] et donc potentiel-lement des souches génotoxinogènes. L’hème d’origine alimentaire, clairement identifiée par ailleurs en tant que facteur de risque, pourrait également favoriser la prédo-minance des bactéries à Gram négatif [53]. Une bactérie du microbiote, Fusobacterium nucleatum, a été associée à la présence d’adénomes coliques [54] : l’abondance de cette espèce était en moyenne multipliée par deux chez des patients atteints d’adénome colique (n = 48) par rapport à des témoins (n = 67). Or, cette augmen-tation est associée à la production accrue de cytokines comme l’IL-10 et le TNFα. Chez des souris déficientes en IL-10, l’inflammation a entraîné approximativement un doublement de l’abondance des entérobactériacées dans le microbiote [55]. Chez ces mêmes souris induites à l’azoxyméthane, la monocolonisation par la souche de E. coli NC 101 produisant la colibactine a entraîné la promotion de carcinomes invasifs dont la fréquence a été significativement réduite par la délétion de l’îlot génétique pks responsable de la synthèse de colibactine [55]. Chez l’homme enfin, il a été montré que la muqueuse colique de patients atteints de cancer colorectal était préféren-tiellement colonisée par des E. coli du groupe B2 pro-ductrices de cyclomodulines, en particulier exprimant la colibactine : 55 % (n = 38) contre 20 % chez des sujets souffrant de diverticulose bénigne (n = 31) [56].Il existe donc un faisceau de résultats concordants sug-gérant un rôle de toxines bactériennes dans l’induction de tumeurs colorectales. Toutefois, des propriétés protectrices ont également été mises en évidence : c’est ainsi que la souche probiotique de E. coli Nissle 1917, qui exprime la colibactine, exerce des propriétés anti-inflammatoires sur des colites induites par transfert de lymphocytes T CD4+ CD45RBhigh à des souris immunodéficientes. Cette protection n’est observée que si Nissle 1917 possède un îlot pks fonctionnel et n’est pas actuellement séparable de son action génotoxique [57].

AGENTS INFECTIEUX ET CANCERS
REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456 // 81
3. Conclusion
On a pu incriminer dans l’étiologie du cancer colorectal des facteurs putatifs qui ont en commun une origine essentiellement alimentaire et des interactions probables avec le microbiote : vitamine D et calcium [58], acides biliaires [59], viande rouge via l’hème de la myoglobine [60], sans mentionner ici les contaminants chimiques qui peuvent agir directement en tant que facteurs génotoxiques.Les données exposées dans cette revue fournissent des arguments plausibles d’un rôle de bactéries colitogènes et/ou génotoxiques dans le cancer colorectal. Ces hypo-thèses nécessitent encore confirmation : il est nécessaire de continuer à explorer les mécanismes qui pourraient initier ou promouvoir les différentes étapes du processus néo-plasique, et de les vérifier dans des modèles génétiques, « humanisés » ou gnotobiotiques. La poursuite de l’examen
épidémiologique des relations entre une colonisation ou une infection et le risque de cancer colorectal pourra s’appuyer sur le séquençage massif du microbiote indépendamment de la culture des bactéries, en considérant toutefois qu’une fonction microbienne clé n’est pas nécessairement fournie par une espèce abondante, et dans un cadre temporel qui intègre le temps de latence dans le développement de ce cancer. Enfin, parce que cette maladie est multifactorielle, la recherche d’une simple relation causale serait trop limi-tative, mais devra se placer dans le cadre d’une microflore complexe et d’une alimentation qui génèrent une myriade de pro- et anti-carcinogènes. Il faudra donc décrypter en profondeur le dialogue entre l’hôte (et son alimentation), les pathobiontes et le microbiote commensal, qui agissent de concert dans le processus néoplasique.
Déclaration d’intérêts : les auteurs déclarent ne pas avoir de
conflits d’intérêts en relation avec cet article.
Références
[1] http://www.e-cancer.fr/publications/69-epidemiologie/629-la-
situation-du-cancer-en-france-en-2012
[2] Jones S, Chen WD, Parmigiani G, et al. Comparative lesion sequen-cing provides insights into tumor evolution. Proc Natl Acad Sci USA 2008;105:4283-8.[3] Fearon ER, Vogelstein B. A genetic model for colorectal tumorigene-sis. Cell 1990;61:759-67.[4] Grady WM, Carethers JM. Genomic and epigenetic instability in colorectal cancer pathogenesis. Gastroenterology 2008;135:1079-99.[5] Bingham SA. Diet and colorectal cancer prevention. Biochem Soc Trans 2000;28:12-6.[6] McGarr SE, Ridlon JM, Hylemon PB. Diet, anaerobic bacterial meta-bolism, and colon cancer : a review of the literature. J Clin Gastroenterol 2005;39:98-109.[7] Mai V, McCrary QM, Sinha R, et al. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity : an observational study in African American and Caucasian American volunteers. Nutr J 2009;8:49.[8] O’Keefe SJ, Ou J, Aufreiter S, et al. Products of the colonic microbiota mediate the effects of diet on colon cancer risk. J Nutr 2009;139:2044-8.[9] Rowland IR. The role of the gastrointestinal microbiota in colorectal cancer. Curr Pharm Des 2009;15:1524-7.[10] Hope ME, Hold GL, Kain R, et al. Sporadic colorectal cancer--role of the commensal microbiota. FEMS Microbiol Lett. 2005;244:1-7.[11] Yang L, Pei Z. Bacteria, inflammation, and colon cancer. World J Gastroenterol 2006;12:6741-6.[12] Candela M, Guidotti M, Fabbri A, et al. Human intestinal micro-biota : cross-talk with the host and its potential role in colorectal cancer. Crit Rev Microbiol 2011;37:1-14.[13] Sinicrope FA. Sporadic colorectal cancer : an infectious disease? Gastroenterology 2007;132:797-801.[14] Sears CL, Pardoll DM. Perspective : alpha-bugs, their microbial partners, and the link to colon cancer. J Infect Dis 2011;203:306-11.[15] Finegold SM, Flora DJ, Attebery HR, et al. Fecal bacteriology of colonic polyp patients and control patients. Cancer Res 1975;35: 3407-17.[16] Sobhani I, Tap J, Roudot-Thoraval F, et al. Microbial dysbiosis in colorectal cancer (CRC) patients. PloS One. 2011, 6, e16393.[17] Scanlan PD, Shanahan F, Clune Y, et al. Culture-independent ana-lysis of the gut microbiota in colorectal cancer and polyposis. Environ Microbiol 2008;10:789-98.[18] Moore WE, Moore LH. Intestinal floras of populations that have a high risk of colon cancer. Appl Environ Microbiol 1995;61:3202-7.
[19] Eckburg PB, Bik EM, Bernstein CN, et al. Diversity of the human intestinal microbial flora. Science 2005;308:1635-8.[20] Itzkowitz SH, Yio X. Inflammation and cancer IV. Colorectal cancer in inflammatory bowel disease : the role of inflammation. Am J Physiol Gastrointest Liver Physiol 2004;287:G7-17.[21] Sears CL. Enterotoxigenic Bacteroides fragilis : a rogue among symbiotes. Clin Microbiol Rev 2009;22:349-69, Table of contents.[22] Wu S, Rhee KJ, Albesiano E, et al. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat Med 2009;15:1016-22.[23] Newman JV, Kosaka T, Sheppard BJ, et al. Bacterial infec-tion promotes colon tumorigenesis in Apc(Min/+) mice. J Infect Dis 2001;184:227-30.[24] Engle SJ, Ormsby I, Pawlowski S, et al. Elimination of colon cancer in germ-free transforming growth factor beta 1-deficient mice. Cancer Res 2002;62:6362-6.[25] Balish E, Warner T. Enterococcus faecalis induces inflamma-tory bowel disease in interleukin-10 knockout mice. Am J Pathol 2002;160:2253-7.[26] Huycke MM, Abrams V, Moore DR. Enterococcus faecalis pro-duces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DNA. Carcinogenesis 2002;23:529-36.[27] Wang X, Huycke MM. Extracellular superoxide production by Enterococcus faecalis promotes chromosomal instability in mammalian cells. Gastroenterology 2007;132:551-61.[28] Babbs CF. Free radicals and the etiology of colon cancer. Free Radic Biol Med 1990;8:191-200.[29] Sinicrope FA. Targeting cyclooxygenase-2 for prevention and the-rapy of colorectal cancer. Mol Carcinog 2006;45:447-54.[30] Wang X, Allen TD, May RJ, et al. Enterococcus faecalis induces aneuploidy and tetraploidy in colonic epithelial cells through a bystan-der effect. Cancer Res 2008;68:9909-17.[31] Risques RA, Rabinovitch PS, Brentnall TA. Cancer surveillance in inflammatory bowel disease : new molecular approaches. Curr Opin Gastroenterol 2006;22:382-90.[32] Chu FF, Esworthy RS, Chu PG, et al. Bacteria-induced intestinal cancer in mice with disrupted Gpx1 and Gpx2 genes. Cancer Res 2004;64:962-8.[33] Kaper JB, Nataro JP, Mobley HL. Pathogenic Escherichia coli. Nat Rev Microbiol 2004;2:123-40.[34] Tenaillon O, Skurnik D, Picard B, et al. The population genetics of commensal Escherichia coli. Nat Rev Microbiol 2010;8:207-17.[35] Dobrindt U, Hochhut B, Hentschel U, et al. Genomic islands in pathogenic and environmental microorganisms. Nat Rev Microbiol 2004;2:414-24.[36] Nougayrede JP, Homburg S, Taieb F, et al. Escherichia coli induces DNA double-strand breaks in eukaryotic cells. Science 2006;313:848-51.

82 // REVUE FRANCOPHONE DES LABORATOIRES - NOVEMBRE 2013 - N°456
[37] Cuevas-Ramos G, Petit CR, Marcq I, et al. Escherichia coli induces DNA damage in vivo and triggers genomic instability in mammalian cells. Proc Natl Acad Sci USA 2010;107:11537-42.[38] Johnson JR, Johnston B, Kuskowski MA, et al. Molecular epide-miology and phylogenetic distribution of the Escherichia coli pks geno-mic island. J Clin Microbiol 2008;46:3906-11.[39] Putze J, Hennequin C, Nougayrede JP, et al. Genetic structure and distribution of the colibactin genomic island among members of the family Enterobacteriaceae. Infect Immun 2009;77:4696-703.[40] Dubois D, Delmas J, Cady A, et al. Cyclomodulins in urosepsis strains of Escherichia coli. J Clin Microbiol 2010;48:2122-9.[41] Escobar-Paramo P, Grenet K, Le Menac’h A, et al. Large-scale population structure of human commensal Escherichia coli isolates. Appl Environ Microbiol 2004;70:5698-700.[42] Clermont O, Lescat M, O’Brien CL, et al. Evidence for a human-specific Escherichia coli clone. Environ Microbiol 2008;10:1000-6.[43] Nowrouzian FL, Wold AE, Adlerberth I. Escherichia coli strains belonging to phylogenetic group B2 have superior capacity to persist in the intestinal microflora of infants. J Infect Dis 2005;191:1078-83.[44] Gordon DM, Stern SE, Collignon PJ. Influence of the age and sex of human hosts on the distribution of Escherichia coli ECOR groups and virulence traits. Microbiology 2005;151:15-23.[45] Kurokawa K, Itoh T, Kuwahara T, et al. Comparative metagenomics revealed commonly enriched gene sets in human gut microbiomes. DNA Res 2007;14:169-81.[46] Kado S, Uchida K, Funabashi H, et al. Intestinal microflora are necessary for development of spontaneous adenocarcinoma of the large intestine in T-cell receptor beta chain and p53 double-knockout mice. Cancer Res 2001;61:2395-8.[47] Kuhn R, Lohler J, Rennick D, et al. Interleukin-10-deficient mice develop chronic enterocolitis. Cell 1993;75:263-74.[48] Reddy BS, Weisburger JH, Narisawa T, et al. Colon carcinogenesis in germ-free rats with 1,2-dimethylhydrazine and N-methyl-n’-nitro-N-nitrosoguanidine. Cancer Res 1974;34:2368-72.
[49] Vannucci L, Stepankova R, Kozakova H, et al. Colorectal car-cinogenesis in germ-free and conventionally reared rats : different intestinal environments affect the systemic immunity. Int J Oncol 2008;32:609-17.
[50] Cario E. Microbiota and innate immunity in intestinal inflammation and neoplasia. Curr Opin Gastroenterol 2013;29:85-91.
[51] Kipanula MJ, Seke Etet PF, Vecchio L, et al. Signaling pathways bridging microbial-triggered inflammation and cancer. Cellular Signalling 2013;25:403-16.
[52] Winter SE, Winter MG, Xavier MN, et al. Host-derived nitrates boosts growth of E. coli in the inflamed gut. Science 2013;339: 708-11.
[53] Ijsennagger N, Derrien M, Van Doorn GM, et al. Dietary heme alters microbiota and mucosa of mouse colon without functional changes in host-microbe cross-talk. Plos One 2012;7(12):e49868.
[54] McCoy AN, Araujo-Perez F, Azcarate-Peril A, et al. Fusobacterium is associated with colorectal adenomas. Plos One 2013;8(1): e53653.
[55] Arthur JC, Perez-Chanona E, Mühlbauer M, et al. Intestinal inflam-mation targets cancer-inducing activity of the microbiota. Science 2012;338:120-3.
[56] Buc E, Dubois D, Sauvanet P, et al. High prevalence of mucosa-associated E. coli producing cyclomodulin and genotoxin in colon can-cer. Plos One 2013;8(2):e56964.
[57] Olier M, Marcq I, Salvador-Cartier C, et al. Genotoxicity of Escherichia coli Nissle 1917 strain cannot be dissociated from its pro-biotic activity. Gut Microbes 2012;3:6:501-9.
[58] Pereira F, Larriba MJ, Munoz A. Vitamin D and colon cancer. Endocrine-Related Cancer 2012;19:R51-R71.
[59] Baptissart M, Vega A, Maqdasy S, et al. Bile acids : from digestion to cancers. Biochimie 2013;95:504-17.
[60] Ferguson L. Meat and cancer. Meat Science 2010;84:308-13.