蛋白质结构与功能的关系
-
Upload
brian-brennan -
Category
Documents
-
view
69 -
download
0
description
Transcript of 蛋白质结构与功能的关系

蛋白质结构与功能的关系

一 .肌红蛋白的结构与功能
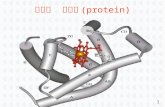
(1)肌红蛋白的功能:哺乳动物肌肉中储存氧并运输氧的蛋白。
(2)肌红蛋白的结构特点: 1963年, Kendrew a .一条多肽链,153个氨基酸残基,一个血红素辅基,分子量1
6700。 b.肌红蛋白的整个分子具有外圆中空的不对称结构,肽链共折叠成
8段较直的 -螺旋体( A-H),最长的有23个氨基酸残基,最短的有7个氨基酸残基。
C. 拐弯处 -螺旋受到破坏,拐弯是由1—8个氨基酸残基组成的无规则卷曲,4个脯氨酸各自出现在一个拐弯处,此外拐弯处还有Ser、 Ile、 Asn、 Thr等残基。
d.具有极性侧链的氨基酸残基分布于分子表面,而带非极性侧链的氨基酸残基多分布于分子内部,使肌红蛋白成为可溶性蛋白。


HC
NA



煤气中毒的机制
一氧化碳( CO)也能与血红素 Fe原子结合。由于 CO与血红素的结合能力是O2 的 200 倍,因此,人体吸入少量的 CO即可完全抑制肌红蛋白或血红蛋白与 O2
的结合,从而造成缺氧死亡。急救方法是尽快将病人转移到富含 O2 的环境中(如新鲜空气、纯氧气或高压氧气),使与血红素结合的 CO 被 O2 置换出来。


( 3)肌红蛋白的氧合曲线
( 1 )
( 2 )
( 3 )
( 4 )
(Y 代表在给定的氧压下肌红蛋白的氧饱和度 )Y=1时,表明所有肌红蛋白的氧合位置均被占据,即肌红蛋白为氧饱和。

( 3)肌红蛋白的氧合曲线
由( 5)可见: Y=0.5时,肌红蛋白的一半被饱和, P ( O2 ) =K=P50 解离常数为肌红蛋白一半被饱和时的氧压。P ( O2 )的单位是 torr,1 torr=1 mm Hg
( 5 )


Po2
Y
Y1-Y =
P(O2)K
logY
1-Y
=log P(O2) -logK
Hill系数 =1.0蛋白质或只含一个结合位点,或含有多个结合位点,而这些结合位点彼此完全独立并有相同的 K 值。Hill系数不等于1.0 ,表明蛋白质含有多个结合位点,而这些结合位点彼此有相互作用。

二 .血红蛋白 (Hb)的结构与功能(1)血红蛋白的功能:存在动物血液的红细胞中,主要功能是结合和运输 O2,还具有运输 CO2的功能;此外,血红蛋白还能和 H+结合,从而可以维持体内 pH。
( 2)血红蛋白的结构特点:a.是四个亚基的寡聚蛋白,两个是一种亚基,两个是另一种亚基,含574 个 AA残基,分子量65000
b.成人的血红蛋白为 22( HbA-96%)、 22 ( HbA2-2%)胎儿的血红蛋白为 22( HbF)
c. 链由 141AA残基组成, 链由 146AA残基组成。 四种肽链的三级结构与肌红蛋白相似,各自内部有一个血红素辅基。



血红蛋白的三维结构
链由 141AA残基组成, 链由 146AA残基组成。 链和链的 H 螺旋缩短, 链还缺失一个很短的 D 螺旋。
每个亚基结合一个血红素基团,血红素位于 E 和 F 螺旋之间的裂隙处,并暴露在分子的表面。
两个 链之间或两个链之间的相互作用很小,两个不同链之间的作用力最大。
不同的血红蛋白的氨基酸序列中有 9个保守氨基酸残基,对血红蛋白的功能很重要。

血红蛋白的三维结构

Hb 的氧合与构象改变
之间的接触有两类,一类是 1
1 和 22接触(主要涉及B 、 G 、 H 和 GH ),叫装配接触;另一类 12 和 21接触(主要涉及 C 、 G 和 FG ),叫滑动接触。氧合作用时,这些接触也发生变化。

血红素铁的微小移动导致血红蛋白构象的转换

与氧结合时血红蛋白的变构过程
血红素中铁原子的变化 高自旋状态 低自旋(非氧合,原子半径较大) (氧合,原子半径较小)

氧合血红蛋白和去氧血红蛋白代表两种不同的构象态

94 146
141 126 40
40 126 141
146 94

与氧结合时血红蛋白的变构过程
亚基三级结构及整个蛋白四级结构的变化
铁原子的位移 F8His 的位移 使 F 螺旋、 EF拐角及 FG 拐角发生位移 F 螺旋向 H 螺旋移动 挤出 HC2Tyr
导致四级结构的盐桥破坏 挤出DPG 分子。

( Hb氧结合曲线)别构蛋白
蛋白质分子中不止有一个配基的结合部位(活
性部位),还有别的配基的结合部位(别构部
位)。别构蛋白都有别构效应。

血红蛋白的氧合曲线
Y—血红蛋白的氧饱和度,等于血红蛋白中被占的氧合部位除以血红蛋白中氧合部位总数。




( Hb氧结合曲线)

H+ 、 CO2 和 BPG 对血红蛋白结合氧的影响
氧亲和力:指血红蛋白对于氧的结合牢固程度,表示为P50。(在一定氧分压下,氧亲和力越高,即氧结合越牢固。相反,氧亲和力越低,组织就能得到更多的氧供应)
H+ 、 CO2 的影响1914 年,丹麦生理学家 C.Bohr发现,高浓度的 H+ 和 CO2促使氧合血红蛋白分子释放 O2 ,而高浓度的 O2促使脱氧血红蛋白分子释放 H+
和 CO2 。——血红蛋白对 O2 、 H+ 和 CO2 结合的这种相互关系叫波耳效应 。

波耳效应 的生理意义
肌肉 pH7.2
肺泡 pH7.6

H+ 、 CO2 对血红蛋白氧合能力影响的解释
H+ 的结合部位
146-His
N-Val
122-His
使血红蛋白保持 T 态

CO2 的结合部位
四个亚基 N-末端氨基
Hb-NH2 + CO2Hb-NH-COO- + H+
氨甲酸衍生物
CO2 + H2O H2CO3HCO3 + H+-
(氧合态)

与亚基的结合部位:Val1--NH3
+
Lys82--NH3
+
His143- 咪唑基His2- 咪唑基
HbO2Hb(O2)2Hb(O2)3 Hb-BPG+4O2Hb(O2)4+BPG

BPG=4.5mmol/L
BPG=7.5mmol/L
BPG=0mmol/L

BPG的影响:
HbO2Hb(O2)2Hb(O2)3
Hb-BPG+4O2Hb(O2)4+BPG
BPG降低血红蛋白亲氧能力的重要生理意义: BPG是红细胞中存在的糖代谢中间产物。当血液流经 O2分压较低的组织时,红细胞中的 BPG可促进氧合血红蛋白释放氧,以满足组织对 O2需要。 BPG浓度越大, O2的释放量越多。红细胞中 BPG浓度的变化是调节血红蛋白对氧亲和力的重要因素。实例:在高山上;肺气肿病人;储藏血液。
BPG和 O2 对血红蛋白的结合是排斥的
1.0
0.5
Po2
Y
有 BPG

E.胎儿血红蛋白的氧合能力大于HbA
胎儿血红蛋白( HbF)为 22,而成人血红蛋白 (HbA)为 22,
与的区别为: 143— His
(BPG与亚基的结合部位:
Val1--NH3+
Lys82--NH3+
His143- 咪唑基 ) 143——Ser,使 HbF与 BPG的结合能力减弱,因而增加了 HbF对氧的亲和力。其意义在于胎儿血液流经
胎盘时 HbF可以从母体 HbA获得 O2。

分子病—指蛋白质分子中由于 AA排列顺序与正常蛋白质不同而发生的一种遗传病 (基因突变造成的 )。
镰刀状细胞贫血病:病人体内血红蛋白的含量乃至红细胞的量都较正常人少,且红细胞的形状为新月形,即镰刀状。此种细胞壁薄,而且脆性大,极易涨破而发生溶血;再者,发生镰变的细胞粘滞加大,易栓塞血管;由于流速较慢,输氧机能降低,使内脏器官供血出现障碍,从而引起头昏、胸闷而导致死亡。
病因:血红蛋白 AA顺序的细微变化 正常人 HbA—N6Glu
病人 HbS—N6Val
血红蛋白分子病





镰刀状细胞血红蛋白的构象变化 研究表明, HbS 和 HbA在氧合状态下没有多大区别。但在脱氧情况下, HbS的溶解度剧烈下降( 1/25 HbA )。
目前发现有 300 多种不同的突变血红蛋白,并且绝大多数突变体中只有一个 AA残基被置换。
Glu侧链在pH7.4时是一个带负电的基团,而 Val侧链是一个非极性基团,在 HbS分子表面造成一个粘性突起,与另一个HbS上的互补口袋通过疏水作用形成聚集沉淀。
EF拐弯

镰刀状细胞血红蛋白的治疗性矫正
CH3
CH3
CH-CH-C- + N C O-
N+H3
OCH3
CH3
CH-CH-C-NHCNH2
O
O
N-末端缬氨酸残基
氰酸钾( KCNO )治疗


免疫系统和免疫球蛋白
浆母细胞 浆细胞 可溶性抗体
记忆细胞 表达膜结合受体(不溶性抗体)
(一)免疫系统免疫系统包括两个互补的系统:体液免疫和细胞免疫。
体液免疫—是针对细菌感染,胞外病毒(存在于体液中)以及进入生物体的外来蛋白质等。
细胞免疫—是破坏被病毒感染的宿主细胞、某些寄生物和外来的移植组织。
免疫反应主要涉及淋巴细胞和巨噬细胞。
B 淋巴细胞—产生于骨髓( bone marrow )中的造血干细胞,在骨髓中完成发育。循环于血液和淋巴系统,通过其上特异的膜受体(抗体分子,糖蛋白)识别抗原。当 B 细胞遇到抗原时,发生分裂和分化。
B 细胞


T 淋巴细胞—产生于骨髓造血干细胞,成熟于胸腺( thymus gland) , 表达膜结合受体(不溶性抗体),称 T 细胞受体,当T 细胞遇到与主要组织相容性复合体( MHC )膜蛋白结合的抗原时,发生增殖和分化。
T 细胞
记忆 T 细胞效应 T 细胞
T 细胞
TH 细胞( T 助细胞)TC 细胞( T 胞毒细胞)
分泌细胞因子(淋巴因子)激活
激活 不分泌细胞因子,但获得细胞毒性。
激活 B 细胞、 TC 细胞吞噬细胞和其他参与免疫反应的细胞
监视身体的 B 细胞和消灭显示不正常抗原的细胞如病毒感染细胞、肿瘤细胞和移植细胞


抗原与抗体的一般概念 抗体( antibody)就是免疫球蛋白(immunoglobulin-Ig),是一类血浆糖蛋白。脊椎动物在遭遇一类异己物质如:病毒、细菌细胞壁或大分子物质(如多糖、核酸和蛋白质等)被称为抗原( antigen)的物质侵入时,自身便产生抗体,这即为免疫反应。能引起免疫反应的任何分子或病原体称为抗原。抗体的特点:高度特异性和多样性半抗原:某些小分子物质可以与抗体结合,但本身并不能刺激抗体产生,当它们与大分子物质(如蛋白质)结合后也能刺激抗体产生,这些小分子物质被称为半抗原 (hapten)。



跨膜蛋白


MHC-I蛋白结合并展示由细胞内随机发生的蛋白质降解和更新衍生来的肽。这些肽和 MHC-I蛋白结合形成的复合体是细胞兔疫系统中 TC 细胞的细胞受体的识别靶。 每个 T 细胞只含一种 T 细胞受体但有多个拷贝.它对特定 MHC-I蛋白 -肽复合体是特异的。为避免产生大批能结合和破坏自身的正常细胞的 TC 细胞,在胸腺中 TC 细胞的成熟包括一个严格的选择过程,消灭 95%以上正在发育的 TC 细胞包擂那些能与展示生物体自身蛋白质的肽的 MHC-I蛋白结合的 TC 细胞。存活并成熟的 TC 细胞是那些具有不与生物体自身蛋白质结含的 T细胞受体的 TC 细胞。结果形成一个专门与连接在宿主细胞 MHC—I蛋白上的外来肽结合的细胞群。这就是所谓兔疫的自身耐受性。

MHC-Ⅱ 蛋白存在于少数几种特化细胞的表面。这些特化细胞包括巨噬细胞和 B 淋巴细胞,它们作为抗原呈递细胞通过吞噬作用或胞吞作用将外来的抗原内化,经消化使成小的肽段。肽段与 MHC-Ⅱ蛋白结合并被展示在抗原呈递细胞的膜上 。MHC-Ⅱ 蛋白结合并展示的肽不是来自细胞的蛋白质,而是被细胞摄入的外部蛋白质。形成的 MHC-Ⅱ蛋白 -肽复合体是各种 TH 细胞的结合靶。它们也和 TC 细胞一样,在胸腺中进行严格的选择,消灭那些能与宿主自身的细胞蛋白质结合的 TH 细胞。


一旦抗原耗尽,被激活免疫细胞大部分在几天内死亡,一部分 B 和 T细胞则成熟为记忆细胞,长期存在于血液中,可再次产生同样的免疫应答反应。

Y 形结构

抗体分子是二价的,而抗原分子可以是多价的








有色产物
底物
第一抗体
第二抗体
酶













![蛋白质药物 液质分析tools.thermofisher.com/content/sfs/brochures/蛋白质... · 2016. 2. 4. · Orbitrap可获得更为清晰的质谱原始数据(图2) [1-3]。高质量的原始数据为分析结果提供了保](https://static.fdocument.pub/doc/165x107/5fe8a4be18eeda7f884d2d36/eceec-etools-ce-2016-2-4-orbitrapeceei2i.jpg)





