Urea
Transcript of Urea

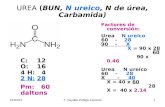
UREA.La urea es la di amida del acido carbónico:Es un producto del metabolismo de las proteínas en el hombre y en los mamíferos. Mediante la urea pudo demostrar Friedrich Woler en 1828 que, contra las ideas entonces imperantes sobre la naturaleza de los compuestos orgánicos, es posible obtenerlos a partir de otros compuestos típicamente inorgánicos que logro transformando el cianato amónico NH4CNO en urea.Para la fabricación técnica de la urea se hacen reaccionar amoniaco y anhídrido carbónico líquidos a unos 150ºC y a 100-200 atm de presión. Así se forma el carbamato amónico:Sal amónica del acido carbamico.A presión ordinaria y ya a 60ºC se descompone el carbamato nuevamente en anhídrido carbónico y amoniaco. Pero si se calienta a presión elevada, desprende agua y se transforma en urea:La realización técnica de este proceso se efectúa de muy diversas maneras. Así se emplean temperaturas entre 100º y 250ºC y presiones comprendidas entre las 100 y 160atm. La reacción entre amoniaco y el anhídrido carbónico es completa solo cuando existe un gran exceso de amoniaco. Pero como además son necesarias presiones altísimas (de hasta 1000atm), se prescinde de lograr la reacción completa y se consideran suficientes rendimientos del 60 al 80%.Los gases residuales se hacen retornar el proceso (método en ciclo cerrado).El método tiene lugar esencialmente en las siguientes fases:1.- se introducen en el reactor a presión2.- los componentes de la reacción NH3 y CO2 y se forma inmediatamente a partir de ellos el carbamato, que por separación se transforma después en urea. Así se forma con el agua separada que eventualmente se ha añadido antes, una solución que contiene urea y carbamato.Esta solución concentrada (75%) es conducida a presión por el tubo,3.- que parte del reactor, a través de una válvula de expansión4.- a la columna en la que,5.- por calentamiento cuidadoso, se desdobla el carbamato no transformado en anhídrido carbónico y amoniaco. Los gases salen por el conducto.Hay una serie de métodos en los que estos gases desprendidos retornan al ciclo, pero dado que el proceso debe de efectuarse bajo presión, existe la dificultad de que en los tubos de conducción se sedimente el carbamato solido y determine obstrucciones en los mismos.6.- Se retira de la columna la solución de urea y se la lleva, mediante una bomba al cristalizador7.- del que también son expulsados los restos de carbamato. Después de centrifugar8.- se conduce el producto listo al tambor mezclador, en el que se le pueden agregar aditivos especiales.Aplicaciones de la Urea.La urea no solamente es un valioso abono: tiene también una gran importancia en las industriales de las resinas artificiales, de los barnices y de las lacas. Los mas conocidos son los productos de condensación de la urea con el formaldehido, entre los que se forman compuestos macromoleculares. Se obtienen estos fácilmente cuando se caliente a ebullición urea con formaldehido en solución acuosa y en medio débilmente acido (ph 4-4,5). Una vez alcanzado el grado de polimerización deseado, se puede impedir que continúe la polimerización por tamponamiento o neutralización. También tiene lugar la polimerización con alcoholes o con fenoles. Con las resinas de urea, juntamente con nitrocelulosa o con resinas alquílicas, se preparan barnices, colas y adhesivos.
Reacción de los fertilizantes en el suelo. Volatilización de amoníaco a partirde la urea.
La urea es la fuente de fertilizante más utilizada. Dentro de las razones que explica la generalización de su utilización, se destaca su accesibilidad económica, su elevada concentración de nitrógeno (N) por unidad de producto (46% de N) y la gran solubilidad en la solución edáfica.

Sin embargo, muchas veces se reduce la eficiencia de su utilización debido a la ocurrencia de pérdidas de N por volatilización de amoníaco (NH3) o por fitotoxicidad provocada por el uso de dosis elevadas de este fertilizante junto con la semilla. Se presentan los conceptos fundamentales para entender la dinámica de estos procesos, y las estrategias disponibles para reducir su incidencia.
Reacción de la urea en el suelo y proceso de volatilizaciónEn suelos con pHs mayores que 6.3, cuando se agrega urea al suelo, ésta sufre un proceso de hidrólisis, generando como productos de la reacción amonio (NH4+) y anión bicarbonato (HCO3-),[pic] La hidrólisis es catalizada por una enzima denominada ureasa. Su actividad es muy importante en los residuos de cosecha y en la parte superficial de los suelos. Siguiendo el patrón de distribución de la materia orgánica (MO) del suelo, la mayor actividad ureásica se concentra en el estrato superficial y se reduce con la profundidad.El amonio liberado en la hidrólisis de la urea queda en equilibrio dinámico con el amoníaco de la atmósfera:[pic]La hidrólisis genera un incremento significativo del pH alrededor del gránulo de urea ya que consume protones. Ese incremento del pH desplaza el equilibrio del amonio y amoníaco favoreciendo la volatilización del NH3 a la atmósfera. Factores que regulan la volatilización de amoníacoEl proceso de volatilización se encuentraafectado tanto por factores del suelo como por el manejo de los fertilizantes. En la tabla 1 se enumeran los factores que mayor impacto tienen sobre la volatilización de NH3.Tabla 1:|Factores de suelo |Factores de manejo de fertilizantes ||Actividad ureásica |Método de aplicación ||Temperatura |Fuente y dosis de fertilizante ||Contenido de agua |Presencia de residuos ||pH y capacidad buffer |Uso de inhibidores ||Capacidad de intercambio catiónico (CIC) | ||Intercambio de aire | |
A- Factores de sueloObviamente, para que ocurra la reacción inicial de hidrólisis es necesario que exista disponibilidad de agua en el suelo. La incorporación de la urea, ya sea mediante alguna práctica de labranza o por acción del agua de lluvia o riego, reduce el N eliminado a la atmósfera como NH3 ya que el fertilizante es muy soluble en agua y se desplaza hacia una zona de menor actividad ureásica.La temperatura es un regulador de cualquier actividad biológica. Por lo tanto, la actividad microbiana productora de la enzima ureasa depende directamente de este parámetro. La incidencia de este factor puede ser considerable en cultivos de verano, cuando las temperaturas superan los 18 a 20 ° C. De todas maneras no se debe tener en cuenta solo un factor sino las condiciones predisponentes a la ocurrencia del proceso de volatilización, que integra a varios factores juntos.El incremento del pH alrededor del gránulo de fertilizante es sin duda el factor desencadenante

de la volatilización de NH3. Suelos que poseen naturalmente pH´s altos (suelos alcalinos o salino-alcalinos) de por sí volatilizan significativamente más que suelos agrícolas con pH moderadamente ácidos. En suelos con mayor capacidad buffer los cambios en el pH por efecto del fertilizante son menores y por ende la pérdida de N por volatilización es de menor cuantía.La capacidad de intercambio catiónica (CIC) de los suelos afecta la volatilización debido a que el amonio liberado de la hidrólisis de la urea queda retenido en los sitios de intercambio y queda menos disponibilidad del catión para ser volatilizado. Suelos mas pesados, con mayor contenido de arcilla y/o con mas materia orgánica poseen capacidad de intercambio catiónicomas alto. B- Factores de manejo de fertilizantesLa selección de la fuente posee gran influencia en la magnitud de la pérdida de N por volatilización de NH3.La ocurrencia de este proceso tiene lugar cuando se utiliza urea como fuente o fertilizantes que contienen urea en su composición (por ejemplo, UAN). Las fuentes que contiene amonio o nitratos en su composición, no generan volatilización en suelos agrícolas.En cuanto a la dosis de fertilizante, cuanto mayor sea ésta, más amonio será producido y por lo tanto la volatilización del NH3 será cuantitativamente más significativa.El método de aplicación debe serconsiderado sobre todo en sistemas de siembra directa, debido a la gran actividad ureásica de los rastrojos en superficie. No son recomendables las aplicaciones de urea al voleo en cobertura total, sobre todo si existen otros factores predisponentes a la volatilización. En estos casos se pueden utilizar fuentes que volatilicen menos como el UAN o que prácticamente no volatilicen, como los fertilizantes que contienen N como nitratos o amonio en suelos con pH moderadamente ácidos Fitotoxicidad por amoníacoSi se aplican grandes cantidades de urea junto a la semilla, se puede producir daño de semillas o inhibir la germinación debido a la acción fitotóxica del amoníaco. Para prevenir este problema, es recomendable agregar no más de 30 kg de N/ha en suelos con mayor contenido de MO y texturas medias, mientras que en suelos de textura gruesa y menor contenido de MO no se debería superar los 12 a 15 kg de N/ha. Estas son dosis orientativas, y pueden variar dependiendo de otros factores: tipo se semillas, pH y CIC del suelo, contenido hídrico en la aplicación, etc.Eficiencia de fertilización: ureas especialesExisten ureas especiales, que por diferentes mecanismos reducen la velocidad con la que se efectúa la hidrólisis enzimática de la urea. Así, encontramos ureas de liberación lenta como la urea-formaldehido; de liberación controlada, como la urea recubierta con aditivos acidificantes (Ej.ureas recubiertas con azufre) y los inhibidores de la ureasa. En este último caso, mediante la incorporación de sustancias inhibidoras temporarios de la ureasa, se reduce la velocidad con la que se genera la hidrólisis, y por lo tanto se minimiza la volatilización del NH3. La utilización de este tipo de productos se encuentraen forma experimental actualmente en la ArgentinaDentro de la gama de productos mencionada, los inhibidores de la ureasa son los que tienen las mejores perspectivas de desarrollo como alternativa para reducir las pérdidas de N-NH3 fuera del sistema suelo-planta. Un ejemplo de este tipo de productos son las fosforamidas, como el nBPT (N-Butil-Tiofosforic triamide). Sin duda, el elevado costo de este tipo de sustancias es una limitante severa para la difusión de este tipo de tecnologías en el ámbito productivo extensivo. |¿Cuánto N se pierde por volatilización de NH3 ? ||Algunos ejemplos locales ||(% del N aplicado) ||Trigo labranza convencional: 0.25% (cuando se aplica a la siembra); 1.5% (cuando se aplica en macollaje al voleo). ||Dosis: 120 kg/ha urea. (Videla, 1994). |

|Trigo siembra directa: 3 al 9%, dependiendo del fertilizante (aplicaciones al voleo)(García et.al., 1996) ||Maíz siembra directa: dosis bajas (70 kg de N /ha) 3 al 7% y del 6 al 11% utilizando dosis altas (140 kg de N/ha)(Sainz||Rozas et.al. ,1997a). ||Pastura de agropiro: fertilización de otoño con urea en suelo Natracuol Típico (con pH 7 en el horizonte superficial): ||12% (dosis de 90 kg de N/ha) y 35% (dosis de 180 kg de N/ha)(Barbieri y Hecheverría, 2000) |
|Código de Buenas Prácticas Agrícolas de la EFMA ||(European Fertilizer Manufactures Association) para el manejo de la urea ||La urea debe ser incorporada, preferentmente durante las operaciones de labranza. ||En suelos arenosos la urea debería ser utilizada solo en la primera aplicación y únicamente cuando se la puede ||incorporar rápidamente. ||En suelos de texturas medias y pesados, la urea puede ser usada tanto en aplicaciones a la siembra como fraccionadas. ||La urea puede ser utilizada para aplicaciones tardías en cereales de invierno. ||La urea debe ser utilizada cuando existe probabilidades de ocurrencia de lluvias o se dispone de riego. ||El uso de la urea en pasturas es apropiado temprano en la estación de crecimiento, durante períodos de lluvia o luego ||de un riego. ||En suelos alcalinos, la urea debe ser incorporada inmediatamente luego de la aplicación. ||Aplicaciones de urea con altas temperaturas y suelos secos, requiere de la incorporación sin demoras. Las aplicaciones ||no deben realizarse en el momento más caluroso del día. ||No aplique urea inmediatamente luego del encalado. ||No aplique urea al suelo cuando hay residuos, abonos recién agregados ni nada que reduzca la adsorción de amonio por ||parte del suelo ||Dependiendo de las condiciones ambientales locales, dosis superiores a 250 kg/ha de N deberían fraccionarse. |
Industria de fertilizantes nitrogenados.
Sobreoferta de fertilizantes nitrogenados en el mercado internacional, apertura comercial, elevado costo de insumos, altas tasas de interés y tipo de cambio apreciado han llevado a este sector a una severa crisis que lo pone al borde de su desaparición.
Los empresarios de este sector resaltan que el amoniaco ha sido considerado erróneamente como un producto sujeto a las políticas del sector petroquímico, cuando 90 por ciento de su consumo

se destina a la agroindustria y, por tanto, debería de definirse una política diferenciada para el sector.
Al respecto la investigación manifiesta que para producir la urea se requiere gas natural, de donde se obtiene amoniaco para su elaboración. Esta fase la controla Pemex por conducto de su filial Petroquímica Cosoleacaque, que vende a la iniciativa privada a precios por arriba de los existentes en el mercado internacional, por lo que “no es restable ni viable económicamente para los empresarios, que tienen pérdidas”.
Subraya: “lo que encarece los costos de producción de fertilizantes es el precio del gas natural, que en algunos casos representa 80 por ciento de los insumos”.
Las empresas que elaboran otros fertilizantes simples nitrogenados y complejos que requieren del amoniaco, también se enfrentan a una fuerte presión a ser desplazadasde su mercado natural, por estar perdiendo competitividad con respecto a las empresas internacionales.
Situación internacional
Las principales vendedoras de fertilizante del mundo son: IMC Global Inc. (EU); Norsk Hydro (países escandinavos); PCS (Canadá); Cargill (EU) y Terra Industries (Noruega). Estas cinco empresas controlan alrededor de 45 por ciento de la comercialización total de fertilizantes en el mundo, refiero Ávila Dorantes.
La industria de fertilizantes en el mundo se ha concentrado en determinadas regiones que tienen ventajas estratégicas en materias primas, que han sido aprovechadas por los fabricantes de este insumo agrícola para desplazar a los productos menos competitivos.
El mercado de amoniaco y fertilizantes nitrogenados tiende a ser dominado por empresarios que disponen de un amplio abastecimiento de gas natural a bajo costo; el de los fosforados, por aquellos que disponen de abundantes reservas de roca fosfórica de fácil extracción.
En el ámbito mundial se observa una estructura oligopólica de la producción de fertilizante, ya que son unos cuantos países los que controlan el mercado. Los exportadores son menores que los importadores, situación que se polariza más en los potásicos y los fosforados, ya que están más concentrados los yacimientos de estos minerales.
Varias decenas de empresas participan en la compraventa de fertilizante en el mercado mundial, y destacan unas cuantas: cuatro de ellas venden alrededor de 100 millones de toneladas de fertilizante, representando más de 30 por ciento de las ventas mundiales.
Por otra parte, los inventarios de fertilizantes nitrogenados en el mundo han estado incrementándose, mientras que el de los fosforados muestra una tendenciaa disminuir y la de potásicos a estabilizarse un poco.
Los precios de los fertilizantes nitrogenados han sido estimulados a disminuir, los de los fosforados a aumentar, mientras que los precios de los potásicos a mantenerse dentro de cierto rango.
Los países del este europeo toda la década de los noventa han tenido problemas en su sector agrícola, por lo que su consumo de fertilizantes ha disminuido y la materia prima con la que producen su fertilizante está subsidiada, por ello sus excedentes son considerables. Asimismo,

países como India y China comenzaron a producir y redujeron el volumen de sus importaciones.
Bibliografía citada y consultada • Barberi, PA, Hecheverría, H.E, 2000. CD XVII Congreso Argentino de la Ciencia del Suelo. • García.F.O, Sarlangue, H, justel, F, Picone, LI. Grattone, F.D. 1996. Fertilización nitrogenada de trigo en siembra directa en sudeste bonaerense. XV Congreso Argentino de la Ciencia del Suelo: 101-102. • Sainz Rozas, H, Echeverría H.E, Studdert G.A, Andrade, FH, 1997a. Volatilización de amoníaco desde urea aplicada al cultivo de maíz bajo siembra directa. Ciencia del Suelo 15: 12-16 • Trenkel, M.E. 1997. Improving Fertilizer Use Efficiency. Controlled-Release and Stabilized Fertilizers in Agriculture.151 p • Videla, CC. 1994. La volatilización de amoníaco: una vía de pérdida de nitrógeno en sistemas agropecuarios. EEA Balcarce INTA Bol.Tec. 131, 16 p. En: Uso de modelos de balance para determinar los requerimientos de fertilizante nitrogenado de trigo y maiz. Roberto Alvarez. 1999. Ed. Eudeba p 14-15 • Watson, C.J. 2000. Urease activity and inhibition. Principles and practice. The International Fertiliser Society. Proceeding N° 4Reacción de los fertilizantes en el suelo. Volatilización de amoníaco a partir de la urea articulos
Ciclo del potasio en agroecosistemas y reacción de los fertilizantes potásicos en el sueloPublicado por Juan José Ibáñez el 19 mayo, 2009 Comentarios (7)
Ing.Agr. Esp. Martín Torres Duggan* * Tecnoagro SRL y Comité de Fertilidad y Nutrición Vegetal-Asociación Argentina de la Ciencia del Suelo (AACS) ¿Cuál es el rol del potasio en la nutrición vegetal?El potasio (K) cumple funciones trascendentes en la fisiología de las plantas. Actúa a nivel del proceso de la fotosíntesis, en la traslocación de fotosintatos, síntesis de proteínas, activación de enzimas claves para varias funciones bioquímicas, mejora la nodulación de las leguminosas, etc. etc. Asimismo, una buena nutrición potásica aumenta la resistencia a condiciones adversas, como sequías o presencia de enfermedades.

Figura 1. Formas de potasio en el suelo (Fuente: De Leikam, Kansas State University) La deficiencias de K no solo pueden determinar pérdidas de rendimiento, sino también pueden afectar la calidad de los productos cosechados. En términos generales, para la mayoría de las especies cultivadas, los síntomas de deficiencia se presentan como clorosis (y en casos severos de carencia, necrosis) en los márgenes y puntas de las hojas. Debido a la movilidad de este nutriente dentro de la planta, es común que los síntomas se evidencien sobre todo en las hojas más viejas. ¿Cuáles son las formas de potasio en el suelo?El K edáfico se encuentra formando parte de diferentes pooles, de distinta disponibilidad para las plantas. La de rápida disponibilidad corresponde al K de la solución del suelo (que representa menos del 1% del K total del suelo). La forma química en la que se encuentra este nutriente es como ión K+, el cual se mueve fundamentalmente por difusión. Este K+ se haya en equilibrio dinámico con el K adsorbido en las arcillas, denominado K intercambiable y con las formas de escasa accesibilidad: K fijado al complejo arcilloso (5-10%) y K estructural o de reserva (90-98%). La tasa de pasaje de formas de K más estables a más lábiles esta determinada por factores ambientales (humedad y temperatura de suelo), así como por la capacidad buffer del suelo. Suelos de texturas medias a arcillosos poseen mayor capacidad buffer que los de texturas gruesas. Por lo tanto, en estos suelos la concentración de K+ en la solución del suelo varía significativamente ante cambios en factores ambientales, mientras que en los suelos arcillosos, el rango de concentración se mantiene relativamente constante. Asimismo, el agregado de K vía fertilizante incrementa rápidamente el nivel de este nutriente inmediatamente disponible, mientras que en suelos de texturas medias a finas, parte del mismo pasa a formas menos lábiles (K

intercambiable o fijado). En la Figura 1 se presenta un esquema de las formas de K en el suelo.
¿Cómo es la dinámica del K en el sistema suelo-cultivo?Desde una perspectiva de manejo racional de los fertilizantes, interesa saber cuáles son las entradas y salidas de K en el sistema suelo-cultivo. De esta manera, la estrategia de fertilización sustentable debería tener como meta maximizar el aprovechamiento del K agregado, y al mismo tiempo minimizar las pérdidas del K fuera del agroecosistema. Las entradas de K al sistema suelo-cultivo provienen básicamente de la fertilización. Esto explica la rapidez con la que se pierde la fertilidad potásica en suelos no fertilizados. En cuanto a las pérdidas, la principal vía corresponde a la extracción por parte de los cultivos y de no existir erosión, la otra vía a monitorear es la lixiviación de K+. Este proceso adquiere más relevancia en suelos de texturas gruesas, y está determinado por una serie de factores: ocurrencia de eventos de lluvia o uso de riego, profundidad del sistema radicular de los cultivos, presencia de flujos preferenciales de agua en el perfil, grado de cobertura, dosis de fertilizante, etc. En suelos como los de la Región Pampeana, debido al reducido movimiento de K+ a través del perfil, la lixiviación de K+ tendría escasa relevancia agronómica. En la literatura científica internacional, se mencionan valores máximos de lixiviación de K+ del orden de 15-20 kg/ha/año, cuando se combinan suelos de texturas gruesas y eventos de lluvias o uso de riego.
Potasio en el Suelo: Fuente: Cerebro de Master Joudas En zonas tropicales y subtropicales, el escenario edáfico cambia totalmente. Las intensas precipitaciones y la presencia de suelos muy meteorizados, determinan que gran parte del K+ disponible en la solución del suelo sea lavado fuera de la zona de aprovechamiento radical. ¿Qué fertilizantes potásicos se utilizan y en qué cultivos? Para analizar el uso de fertilizantes potásicos en la Argentina es necesario diferenciar la fertilización en cultivos extensivos (cultivos de granos de la Región Pampeana) y los cultivos intensivos. La fertilización potásica en cultivos de granos de Región Pampeana es prácticamente nula, debido a la elevada disponibilidad de K de los suelos en esta ecoregión. El principal material original de estos suelos consiste en sedimentos provenientes de áreas periglaciares del área cordillerana argentina (región Andina)

transportados por el viento y también por ríos. La mineralogía de estos sedimentos (Loess) es rica en diversos minerales como la mica, que le confirieron a los suelos actuales una elevada concentración de K intercambiable y minerales de arcilla como la illita, caracterizada por presentar K interfilar, que cumple una función de estabilización de las celdas unitarias, pero que pueden liberar K al sistema. Por el contrario, en cultivos intensivos se utilizan diversos fertilizantes o fuentes potásicas, tanto en aplicación a suelo (fertilizantes granulados) como en sistemas de fertirrigación (fertilizantes hidro-solubles o cristalinos) (Tabla 1). Tabla 1. Principales fuentes potásicas, su contenido de nutrientes y los cultivos en los que se utilizan (en base a Nathan, 1997 y Melgar & Camozzi, 2002). Fertilizante %K2O pH Reacción Cultivos Nitrato de potasio 44 8.5 Básica Tomate, pimiento, florales, etc. Sulfato de potasio 50 3.4 Acida Tabaco, frutilla, berries, etc. Cloruro de potasio 60 6.5 Mod. Básica Arroz, cítricos, caña de azúcar. El cloruro de potasio se utiliza en mezclas físicas con destino al cultivo de arroz y fruticultura. También se aplica en cultivos tolerantes a la presencia de cloruros o a la salinidad. El nitrato de potasio es quizás la fuente más popular entre las economías regionales y en particular en horticultura, debido a su versatilidad tanto en su utilización directa como para el armado de mezclas multinutrientes con otras fuentes en formulaciones para fertirriego. El sulfato de potasio es un fertilizante clásico en las mezclas para tabaco, ya que este cultivo demanda mucho potasio y es sensible a los cloruros. La excepción entre los fertilizantes potásicos de uso en la agricultura pampeana es el sulfato doble de potasio y magnesio (“sulpomag”), que se comercializa mayoritariamente en mezclas físicas para soja y maíz, aunque su éxito quizás radique más por su aporte de azufre y magnesio (Melgar y Torres Duggan, 2005). ¿Cómo reacciona el fertilizante potásico en el suelo? Una vez disuelto el gránulo del fertilizante en el suelo, los nutrientes se incorporan en la dinámica del sistema suelo-cultivo. El K proveniente del fertilizante se ionizan y podrán tener diferentes destinos: consumo por parte del cultivo (solución del suelo), adsorción en arcillas (formando parte de los cationes de cambio). El acceso del K+ al sistema radicular del cultivo es mediante difusión e intercepción radicular. En suelos arenosos es posible también que se presenten movimientos verticales en el perfil y pérdidas por lixiviación. Si se utiliza cloruro o nitrato de potasio, los aniones acompañantes son muy móviles en el perfil y se mueven por flujo masal. Si se utiliza sulfato de potasio, el sulfato también es considerado un anión móvil pero menos que los nitratos. Share on linkedin Share on google Share on email More Sharing ServicesCompartir Etiquetas: Fertilidad de Suelos y Nutrición Vegetal, Los Suelos las Plantas y la VegetaciónSi te gustó esta entrada anímate a escribir un comentario o suscribirte al feed y obtener los artículos futuros en tu lector de feeds. Comentarios
Comentario by andrea stumpf el 4 agosto 2009 @ 9:03
Ciclo del Azufre en Agroecosistemas y Reacción de los Fertilizantes Azufrados en el SueloPublicado por Juan José Ibáñez el 26 mayo, 2009

Comentarios (3)
Ing.Agr. Esp. Martín Torres Duggan* Tecnoagro SRL y Comité de Fertilidad y NutriciónVegetal-Asociación Argentina de la Ciencia del Suelo (AACS) ¿Cuáles son las formas de azufre en el suelo? El rango típico de concentración total de S en suelos agrícolas de regiones húmedas y sub-húmedas es 0,1-0,5 g kg-1. Contenidos menores, del orden de 0,02 g kg-1, se pueden presentar en suelos muy meteorizados de zonas húmedas. Valores más elevados (35 g kg-1) se observan en suelos con aportes de origen marino, y de hasta 50 g kg-1 en suelos calcáreos y salinos de zonas áridas y semiáridas. El S se encuentra en el suelo como SO42- en la solución, SO42- adsorbidos en la fase sólida, minerales con azufre y en la materia orgánica (MO). En regiones húmedas y semi-húmedas, más del 95% del S total se encuentra en forma orgánica La forma biodisponible corresponde a los SO42- en solución, cuya concentración varía desde <2 mg kg-1 de S en suelos cultivados de regiones húmedas y subhúmedas a más de 1000 mg kg-1de S en zonas áridas y semiáridas.
Ciclo del Azufre. Fuente: Kalipedia. La comprensión de la naturaleza y propiedades de las formas orgánicas de S en suelos resulta muy relevante, debido a que las mismas gobiernan la liberación de S disponible para los cultivos. Existen diversos enfoques para realizar fraccionamientos de S orgánico: extracción química seguida de separación físico-química en ácidos húmicos, fúlvicos y huminas; separación física a través de tamaño de fracciones organo-minerales y

fraccionamientos moleculares. En cuanto a las formas químicas de S en suelos, si bien gran parte de los compuestos orgánicos edáficos continúan sin identificarse, de acuerdo con Tabatabai (2005), es posible mencionar tres grupos de compuestos orgánicos azufrados:
Ciclo de Azufre: Fuente: MEC 1-S orgánico que no está directamente unido con el carbono (C) y corresponderían a ésteres de sulfatos con uniones C-O-S (e.g., arilsulfatos, sulfato fenólico, polisacáridos sulfatados, entre otros). Otros compuestos orgánicos podrían estar presentes como sulfamatos (C-N-S) y tioglucósidos sulfatados (N-O-S). Esta fracción puede representar entre 30 y 60 % del S total orgánico, con una media del 50 %, en suelos de regiones húmedas y subhúmedas. 2-S orgánico directamente unido a C (C-S). Esta fracción correspondería en gran medida a S en forma de aminoácidos como metionina, cistina y cisteína. La concentración en suelo varía entre 10 y 30 % del S orgánico total, pero se han reportado valores de hasta 58 % en suelos de Québec (Tabatabai, 2005). 3-S orgánico no reducido por los reactivos utilizados en la estimación de las fracciones 1 y 2. Esta fracción se halla en el rango de 30 a 40% del S orgánico total. Considerando su gran resistencia a la degradación química, es una fracción de escaso valor como fuente de S disponible para las plantas. En la Argentina son muy escasos los estudios publicados sobre dinámica del S en el suelo, en especial en lo referido a la caracterización de formas químicas. Un trabajo relevante en este sentido lo constituye el efectuado por Mizuno et al., (1990) quienes analizaron muestras superficiales y perfiles de suelos de diferente desarrollo morfológico en ambientes de la Región Pampeana. Los valores de S total variaron entre 205 y 363 mg kg-
1 en horizontes superficiales. El S reducible con ácido yodhídrico varió alrededor del 50% del S total, mientras que el S orgánico superó el 97% con proporciones variables de S de ésteres y S unido a C. La concentración de las diferentes formas fue mayor en Argiudoles típicos que en Hapludoles típicos. En general, la concentración de las fracciones se reducía en profundidad. Asimismo, estos autores hallaron una elevada correlación entre el S total y el C orgánico y entre el S total y el P orgánico. La relación C/S fue

inferior a 100, disminuyendo en profundidad. El S total se relacionó en forma inversa con el pH de los horizontes estudiados. Investigaciones más recientes indicaron escasa variación en los contenidos de C, H y O en ácidos húmicos de suelos con diferentes texturas, aunque variaron los contenidos de N y S. Esto determinó cambios relevantes en las relaciones C:N, C:S y N:S (Galantini et al.,2008). El ciclo del S en el sistema suelo-planta está gobernado por procesos biológicos y físico-químicos, con activa participación de la biota del suelo (Haneklaus et al., 2007). La fertilización con S ya sea en forma de SO42- o como Sº representa el principal ingreso de S. Otros aportes que pueden ser importantes son el riego y las capas freáticas. La contribución de las formas gaseosas de S son poco significativas en áreas alejadas de centros urbanos, industriales o distantes del mar. Las principales pérdidas o salidas de S de los agro-ecosistemas corresponden a la remoción por los productos cosechados, lixiviación y escurrimiento. La adsorción y las pérdidas gaseosas desde la superficie del suelo o desde las plantas presentan menor relevancia (Haneklaus et al., 2000). Los principales biogeociclos internos del S en suelos son la mineralización-inmovilización y la oxidación. La mineralización es el proceso por el cual el S presente en las fracciones orgánicas edáficas se transforman en SO42- biodisponibles para las plantas. En el caso del S y a diferencia de lo que ocurre con el N, es posible diferenciar dos tipos o mecanismos de mineralización: mineralización biológica y mineralización bioquímica (Anderson et al., 2006, Heneklaus et al., 2007). La mineralización biológica de S está determinada por la demanda microbiana de C para proveer energía para su crecimiento, liberando SO42- como subproducto de la oxidación del C a CO2. La transformación se realiza principalmente a través de microorganismos, por lo cual los factores que afectan la actividad microbiológica (e.g., temperatura, humedad, pH y disponibilidad de sustrato) también influyen en los procesos de mineralización, inmovilización, oxidación y reducción. Este proceso es similar al de la mineralización del N. La mineralización bioquímica, en cambio, implica la liberación de SO42- desde el pool de sulfato-ésteres a través de una hidrólisis enzimática. La arilsulfatasa es la principal enzima catalizadora en suelos. El “pool” de éster sulfato (S-O) tiene importancia en la mineralización de corto plazo, mientras que el S ligado al C, constituye una fracción importante para la mineralización de largo plazo. La contribución de la mineralización a la demanda de S del cultivo es baja (1,7-3,1%). Por lo tanto, en esquemas de alta productividad, la fertilización azufrada constituye una herramienta fundamental para sostener los requerimientos de S de los cultivos.

Figura 1. Ciclo del azufre en el sistema suelo-cultivo (Kansas State University) ¿Cuál es la función del azufre en las plantas y su importancia en la producción vegetal? El S es un elemento esencial para la nutrición vegetal, con requerimientos similares a los de fósforo (P), pero considerablemente más bajos que nitrógeno (N) y potasio (K). Las raíces absorben S como SO42- y luego lo reducen dentro de la planta durante la síntesis de compuestos orgánicos. A diferencia de lo que ocurre con el N, el S presenta escasa movilidad dentro de la planta, determinando que los síntomas de deficiencia se observen en las hojas más nuevas. El S participa en importantes procesos bioquímicos y fisiológicos en las plantas superiores como la biosíntesis de proteínas y lípidos, fotosíntesis, asimilación de N, fijación biológica de N, entre otras (Mengel y Kirkby, 2000; Rice, 2007). La concentración de S en tejidos vegetales varía considerablemente según la familia y especie botánica y se encuentra asociado con el requerimiento fisiológico. En general, las gramíneas presentan menor concentración de S en tejidos que las

dicotiledóneas. El índice de cosecha medio del S (i.e., proporción del S en grano en relación a la biomasa total) es más bajo que en N o P. El requerimiento y extracción de S en base seca es 5, 4 y 5 kg de S Mg-1 de grano y 2, 1 y 4 kg de S Mg-1 de grano, para trigo, maíz y soja, respectivamente (Ciampitti & García, 2007). En las figuras 2 y 3 se presentan las áreas con deficiencia de S en la Región Pampeana argentina y los balances de S y otros nutrientes, respectivamente.
Figura 2. Regiones con deficiencias de azufre en la Región Pampeana argentina (Darwich, 2005). Los números corresponden a localidades.

Figura 3. Balances de nitrógeno (N), fósforo (P), potasio (K) y azufre (S) en la Región Pampeana. Razones de insumos/exportaciones para el periodo2004-2005 con dosis de 28% 42%, 2% y 13% deN, P, K. S, respectivamente.
¿Cuáles son los principales fertilizantes azufrados utilizados en la agricultura? La mayor parte de las fuentes azufradas utilizadas en agricultura presentan el S como SO42- y varían desde muy poco solubles (e.g., yeso agrícola) a muy solubles (e.g., sulfato de amonio, sulfato de magnesio). Como fuentes insolubles sólidas, la más importante es el Sº, que primero debe oxidarse a SO42- para ser aprovechado por las plantas (PPI, 1997). En la Tabla 1 se resumen los principales fertilizantes azufrados de origen químico o mineral utilizados en la agricultura. Tabla 1. Principales fuentes azufradas utilizadas en agricultura(adaptado de Fertilizer Manual, 1998 e PPI, 1997) Fertilizante Fórmula química % de S Forma S Estado de agregación
Sulfato de amonio (NH4)2SO4 24 SO42- Sólido Tiosulfato de amonio (NH4)2S2O3 26 S2O32- Líquido (solución)Sal de Epsom MgSO4.7H2O 13 SO42- SólidoYeso agrícola CaSO4 . 2H2O 12-18 SO42- SólidoSulfato de magnesio hidratado Mg SO4 . H2O 22 SO42- SólidoSulfato de magnesio anhidro Mg . SO4 26 SO42- SólidoSulpomag K2SO4 2 .MgSO4 22 SO42- SólidoSulfato de potasio K2SO4 18 SO42- Sólido

Azufre elemental S° 30-100 S° SólidoSuperfosfato simple Ca (H2PO4)2
+CaSO4.2H2O 14 SO42- SólidoSuperfosfato triple Ca (H2PO4)2
+CaSO4.2 H2O <1 SO42- Sólido En la Región Pampeana, las principales fuentes azufradas sólidas utilizadas en cultivos de granos son el sulfato de amonio (SA), yeso agrícola (YS) y superfosfato simple de calcio (SPS) (Torres Duggan, 2008, Rodríguez, 2007). EL SA también es considerado una fuente nitrogenada, lo mismo con el SPS, que es una fuente fosfatada y azufrada. Todas estas fuentes son solubles en agua. El YS es la fuente sulfatada sólida menos soluble (2,6 g L-1 a 25°C), considerablemente más baja que las sales solubles (Porta et al., 2003). Esta fuente, al igual que otros minerales utilizados en la agricultura pueden variar considerablemente en su pureza y contenido de S. Relevamientos de muestras de YS efectuados en la Argentina indican importantes variaciones en su pureza mineralógica y contenido de S biodisponible (Ponce y Torres Duggan, 2005; Torres Duggan, 2007). Estas variaciones también se pueden presentar en fuentes azufradas de origen mineral como el AE. Sin embargo, a diferencia de lo mencionado con el YS, la tendencia en la provisión moderna de este tipo de agro-minerales se orienta hacia fuentes de AE más concentradas en S. En el ámbito agropecuario, el azufre elemental (AE) es utilizado principalmente como enmienda para corregir la alcalinidad de suelos. Sin embargo, el uso del AE como fertilizante azufrado, también representa un destino relevante. El consumo de AE registró un importante crecimiento a nivel global, sobre todo en regiones como China, Africa y Latinoamérica. En la Argentina el uso de esta fuente es escasa, pero con un potencial interesante, tanto en como fuente azufrada individual, como formando parte de fertilizantes compuestos. ¿Cómo reaccionan los fertilizantes azufrados en el suelo? Los fertilizantes azufrados solubles en agua (e.g. SPS, yeso, sulfato de amonio, etc.) una vez aplicado en el suelo y solubilizado el gránulo se encuentra disponible para las plantas. El SPS presenta una reacción inicial relativamente ácida, el yeso presenta reacción neutra y el sulfato de amonio una reacción ácida. Una vez disuelto los gránulos del fertilizante, el sulfato ingresa en las interacciones del suelo y también de las plantas, quedando sometido a los diferentes procesos mencionados previamente (absorción por las plantas, pérdidas, etc.). La disponibilidad de S del AE depende tanto de factores vinculados con el tipo de mineral (área superficial específica), tipo de suelo (actividad microbiana, pH, MO, etc) y también de las condiciones ambientales tras la aplicación, fundamentalmente temperatura y humedad. El azufre elemental (S°), cuando se trata de productos con elevada pureza, puede contener más del 95% de S. Se lo utiliza tanto como acidificante de suelos, como fuente de S en productos complejos y mezclas físicas. El S elemental, debe oxidarse en el suelo para luego producir sulfatos disponibles para los cultivos.
S° + 2 02 + H2O —› H2SO4 Esta reacción, generadora de acidez, esta mediada principalmente por bacterias del género Thiobacillus y como en todo proceso biológico, la velocidad de la reacción esta determinada básicamente por la temperatura y en este caso particular también por el potencial de óxido- reducción del suelo. Otros factores que inciden en la tasa de disolución y reacción del producto son el tamaño de partícula y la forma de aplicación. Si bien se ha detectado oxidación microbiana a bajas temperaturas (4° C), el rango térmico óptimo se encuentra entre 25 y 35 °C, siendo muy lento a temperaturas menores a 10 °C (Darwich, 1998). Share on linkedin Share on google Share on email More Sharing ServicesCompartir Etiquetas: Componentes, Estructuras y Procesos en los Suelos, Degradación de Suelos: Contaminación, Fertilidad de Suelos y Nutrición Vegetal

Si te gustó esta entrada anímate a escribir un comentario o suscribirte al feed y obtener los artículos futuros en tu lector de feeds. Comentarios
Comentario by AGUSTIN ARANDO MAMANI el 20 agosto 2010 @ 17:16 señor.reciba un cordial saludo,le escribo desde potosi-boliviapara indicarle que en esta todavia no se sta aplicandocon el azufrey el yeso.nosotros en esta tenemos por cantidades estos materias primas.por favor indicarme como puedo preparar para mis sembradios.agrdecere muy deveras por su coperación.atte. agustinComentario by daniela loyo el 23 octubre 2010 @ 22:51 esta muy buena!!!!! esta pagina me encanta me ayuda aprender un poco mas saludos a quien la realizo…….. besosComentario by Adriana Sala el 30 junio 2011 @ 21:21 Excelente informacion y sobretodo muy completa sigan asiii nos estan ayudando mucho.. y de gran manera……… saludos.!!!!!!!!!Escribe un comentario
Ciclo del fósforo en agroecosistemas y reacción de los fertilizantes fosfatados en el sueloPublicado por Juan José Ibáñez el 13 mayo, 2009 Comentarios (9)

Ing.Agr. Esp. Martín Torres Duggan* Tecnoagro SRL y Comité de Fertilidad y Nutrición Vegetal-Asociación Argentina de la Ciencia del Suelo (AACS) Este material forma parte de una serie de posteos que me propuse escribir sobre los principales ciclos biogeoquímicos de los nutrientes esenciales que limitan la producción de cultivos. Hace algunos meses presentamos el del nitrógeno, en esta oportunidad abordamos el caso del fósforo….
Ciclo del Fósforo. Fuente: MEC ¿Cuál es la importancia del fósforo en el crecimiento y fisiología vegetal? El fósforo (P) constituye uno de los macronutrientes esenciales para el crecimiento vegetal, junto con el nitrógeno y él potasio. El P cumple importantes funciones bioquímicas y fisiológicas, como formar parte de biomoléculas (e.g. fosfolípidos, proteínas, nucléotidos, ATP, etc.). Desde el punto de vista bioquímico, forma parte de las unidades monoméricas (“ladrillos”) de las cadenas polinucleótidas como el ADN, le confiere al P una función muy relevante. Por ello, se suele comentar en algunos artículos de divulgación que el P es fundamental para la vida, puesto que forma parte de las unidades fundamentales que la hacen posible. Desde una perspectiva agronómica y de producción vegetal, el P cumple importantes funciones:
Estimula el crecimiento y expansión foliar Promueve el crecimiento de las raíces Mejora la calidad de frutos, granos, etc.
En esquemas de producción sustentables, el P forma parte de los programas de fertilización, a través del uso de fertilizantes químicos, agro-minerales (e.g. roca fosfórica) o enmiendas orgánicas (e.g. estiércol, compost, etc.), dependiendo de las características de los sistemas productivos. ¿A que llamamos ciclo del fósforo y cual son sus componentes?

El conocimiento de los ciclos biogeoquímicos de los nutrientes a escala de sistema suelo-cultivo, permite conocer la estructura y funcionamiento de los nutrientes en dicho sistema, fundamental para la comprensión y también para la toma decisiones de manejo agronómico. Existen numerosas formas de representar el ciclo del P en agro-ecosistemas. En la Figura 1 se presenta un ejemplo. Dentro del ciclo del P, los ingresos de P al sistema corresponden al agregado de P a través de fertilizantes. En suelos sin erosión, las salidas de P de los agroecosistemas están conformadas por la remoción de P por las plantas (e.g., granos, frutos, etc.). Los demás procesos podemos considerarlos como “ciclados” o ciclos internos. Las plantas absorben el P que se encuentra en la fracción “soluble”, que presenta muy baja concentración. Este “pool” se encuentra en equilibrio dinámico con las demás fracciones, que abastecen a la fracción del P en solución. La forma química en la cual las plantas absorben el P es como ión ortofosfato ácido o diácido. Por tratarse de un nutriente poco móvil en el suelo, la llegada del P al sistema radicular de las plantas ocurre básicamente por difusión e intercepción radicular (Figura 2). La velocidad del proceso de difusión depende de varios factores, siendo los mas importantes la diferencia de concentración de P en el área de difusión, la temperatura, la humedad edáfica y la tortuosidad del suelo.
Figura 1. Ciclo biogeoquímico del fósforo en agroecosistemas (IPNI, Cono Sur).

Figura 2. Movilidad de nutrientes en el suelo (Dale Leikam, 2007. Kansas State University) La reserva de P del suelo se encuentra tanto en la materia orgánica (MO) como en compuestos inorgánicos. Las proporciones de compuestos orgánicos e inorgánicos dependen del tipo de suelo y edafogénesis. En el sudeste de la Región Pampeana argentina, las menores temperaturas determinaron procesos de edafización con una importante génesis de compuestos orgánicos humificados, que generan que el P pueda representar el 80% del P total, mientras que en el norte de Buenos Aires y sur de Santa Fe, las mayores temperaturas durante la edafogénesis inducen menores acumulaciones de MO humificada, con proporciones de P orgánicos del orden del 50%, según tipo de suelo. Evidentemente, la degradación de los suelos por erosión, han dado lugar en las últimas décadas pérdidas muy considerables de MO y los nutrientes principales asociados a esta fracción edáfica (N, P, S, algunos micronutrientes, etc.). En cuanto a los compuestos inorgánicos, el P en el suelo se encuentra en diversas formas mineralógicas, cuyo abordaje escapa el alcance de este posteo. La apatita, y sus diferentes formas mineralógicas, constituyen una forma importante del P inorgánico del suelo, y su origen es heredado a partir del material originario, cuyo principal aporte corresponde al Loess, depositado desde zonas periglaciares del oeste de la Argentina (zona Andina) tanto por acción del viento como por los ríos.El P orgánico requiere ser mineralizado a formas inorgánicas (iones ortofosfatos) para que pueda ser aprovechado por las plantas. El proceso de mineralización del P se

la puede dividir en mineralización biológica y bioquímica. La mineralización biológica corresponde a la degradación microbiana de compuestos orgánicos donde el P se encuentra ligado al carbono (C), y cuyo producto de degradación es el CO2. Este proceso es el mismo por el que se libera N y S, dependiendo fundamentalmente de la temperatura y humedad edáfica. La mineralización bioquímica es mediada por enzimas (e.g. fosfatasas) y también puede representar una proporción importante de P mineralizado. Los residuos aportados por los cultivos, si bien no constituyen un ingreso de P al sistema suelo-cultivo, sí representan importantes fuentes de nutrientes biodisponibles para el cultivo, dependiendo de la relación C: N y C:N:P del material, y también del ambiente edáfico (temperatura, humedad, pH, etc.). Cuando las relaciones C:N son mas bajas (e.g. residuos de leguminosas como soja) puede haber liberación neta de nutrientes, mientras que en los residuos con mayores relaciones C:N, puede verificarse inmovilización transitoria de nutrientes. Las diferentes formas orgánicas e inorgánicas se pueden clasificar también según la “labilidad” o biodisponibilidad para las plantas. Compuestos inorgánicos poco lábiles podrían ser aquellos de naturaleza aromática muy condensada presentes en el humus, mientras que los minerales fosfatados primarios, podrían ser ejemplos de pooles de P poco lábiles y por ende de escasa disponibilidad para la nutrición vegetal. Las fracciones más lábiles corresponden a fracciones más jóvenes, que provienen de los residuos de los cultivos, y tienen una importante función en el abastecimiento de P de corto plazo. Los sistemas de cultivo bajo siembra directa estabilizados, con una fertilización balanceada (aporte de nutrientes limitantes para el sistema de producción) y con elevado aporte de C al sistema. Conceptualmente debemos entender que todas las fracciones de P mencionadas (P lábil, no lábil o poco lábil, etc.) tanto orgánicas como inorgánicas, se encuentran en permanente equilibrio, siendo las poco lábiles el pool o fracción de reserva de P del sistema. Los cultivos van agotando el P en solución, que se encuentra muy poco concentrado, y dichas zonas de agotamiento son progresivamente abastecidas desde fracciones más lábiles y estas últimas son provistas por formas de P de reserva o no lábiles. Con fines de diagnóstico de fertilidad de suelos, se evalúan diferentes extractantes de P que se correlacionen con la absorción y/o acumulación de biomasa de cultivos. Estos estudios se denominan de “correlación”. Para este fin, resulta frecuente utilizar plantas de raigrás o alguna especie similar en ensayos de invernadero, donde es posible controlar el ambiente y reducir fuentes de variabilidad. Una vez seleccionados los extractantes (e.g. P Bray 1, P Olsen, etc.) que mejor correlacionan con el crecimiento (i.e., acumulación de biomasa) se pasa a la segunda etapa que consiste en la calibración de la técnica analítica. Los ensayos de calibración, que pueden ser en el campo y también en ensayos de invernadero, tienen como objetivo evaluar la relación entre la respuesta a la fertilización con P y el contenido del extractante en el suelo. En la Región Pampeana argentina se dispone de calibraciones para realizar recomendaciones de fertilización fosfatada en diversas regiones edafo-climáticas y cultivos. Esta información puede ser consultada en el sitio web del IPNI Cono Sur, INTA, Universidades, AAPRESID, etc. ¿Cuáles son los fertilizantes utilizados en fertilización de cultivos de granos en la Región Pampeana argentina? Existen numerosos fertilizantes fosfatados utilizadas en la agricultura argentina. En la Tabla 1 se presentan las más difundidas en la Región Pampeana. El uso de fuentes orgánicas es poco relevante en cultivos de grano, siendo más utilizados en cultivos hortícolas. También el uso de roca fosfórica es muy escaso, por lo cual no son abordados en este escrito. Tabla 3. Contenido de nutrientes de principales fuentes fosfatadas (Adaptado de Melgar y Camozzi, 2002). Fertilizante Contenido de P2O5 (%) Otros nutrientesFosfato monoamónico (MAP) 52 11% de NFosfato diamónico (DAP) 46 18% de NSuperfosfato Simple (SFS) 21 12% de S y 20% de Ca Superfosfato Triple (SFT). 46 14% de Calcio

Los fertilizantes fosfatados denominados “superfosfatos” contienen como forma de P al fosfato monocálcico. Los fosfatos de amonio, que son los más solubles en agua, contienen P como aniones ortofosfatos. El superfosfato simple (SFS) tiene niveles variables de sulfato de calcio bihidratado dentro de su composición. Este “yeso residual” se produce como consecuencia de la reacción del ácido sulfúrico con la roca fosfórica (rica en calcio) durante el proceso de fabricación del fertilizante. En la Figura 3 se muestra la evolución del consumo de fertilizantes fosfatados en la Argentina en los últimos años. Podemos observar que los fosfatos de amonio lideran el ranking en términos de volumen consumido. Del mismo modo cabe resaltar como, en los últimos años, la utilización del MAP viene expandiéndose marcadamente en detrimento de los volúmenes de DAP. También es interesante constatar el incremento que se viene registrando en el consumo de SPS en los últimos años, posicionado fundamentalmente en el mercado de soja.
Figura 3: Evolución del consumo de fertilizantes fosfatados en la Argentina en los últimos años (Melgar, 2005). ¿Cómo reaccionan los fertilizantes fosfatados en el suelo? La reacción inicial de los fertilizantes fosfatados en el suelo depende, además de la forma química en las que se encuentra el P en el producto, del pH del medio y en gran medida de la interacción de los fosfatos con las arcillas y óxidos presentes en la fase sólida del suelo. Los superfosfatos, por tener Ca en su composición, generan alrededor del gránulo residuos de fosfatos dicálcicos de muy baja solubilidad. Los fosfatos de amonio, por no tener Ca, no generan esos productos residuales de baja solubilidad durante la reacción inicial en el suelo (Melgar y Camozzi, 2002). El pH de disolución de las fuentes fosfatadas varía considerablemente. El superfosfato triple genera alrededor del gránulo una solución saturada muy ácida, con un pH de alrededor de 1.5, mientras que el pH de disolución del MAP es de 3.5 y del DAP de alrededor de 8. Estos procesos de disolución involucran un volumen muy reducido de suelo, son temporarios y no atesirarán una gran influencia en el pH global del suelo, a pesar de que pueden incidir sobre la nutrición de los cultivos en alguna etapa fenológica específica (Young et. al. 1985). Los autores también reportan el clásico efecto positivo del amonio en la eficiencia de aprovechamiento del P aplicado. Cuando se aplican productos de P amoniacales (MAP, DAP) la absorción de amonio por las plantas determinaría una acidificación a nivel de la zona rizosférica que mejoraría el aprovechamiento del P por una mejor disolución de los fosfatos. A pesar de estas variaciones en la reacción inicial de las fuentes fosfatadas, numerosos ensayos de fertilización no encuentran diferencias en eficiencia de aprovechamiento entre fuentes fosfatadas, cuando se consideran iguales dosis de P aportadas y no se presentan limitantes de N (Baumer, 1999). Sin embargo, las características químicas del fertilizante resultan fundamentales para analizar la tecnología de fertilización utilizada, en especial la forma de aplicación. Así, el autor reporta

mayores niveles de fitotoxicidad con DAP respecto del MAP en aplicaciones en conjunto con la semilla y realiza recomendaciones de aplicación diferencial parta cada una de las fuentes, siendo mayores las dosis de riesgo (dosis máxima a utilizar) en MAP que en DAP, si bien es conocido que sobre el fenómeno de la fitotoxicidad inciden numerosos factores como tipo de suelo (textura, MO, etc.), humedad del perfil, distanciamiento entre hileras, cultivo, etc. Este tema se puede profundizar en Ciampitti et. al. (2006). Independientemente de la fuente fosfatada utilizada, una vez que el fertilizante es disuelto e incorporado en el suelo, los aniones ortofosfatos son influenciados por los procesos y equilibrios químicos presentes en el mismo. Así, el P agregado pasa a formar parte de las diferentes fracciones del suelo (pooles) que tienen distintos grados de biodisponibilidad: solución de suelo, P retenido en arcillas y óxidos, P no lábil (P precipitado o de baja solubilidad), etc. El P presente en la solución de suelo es muy baja, y es de donde las plantas absorben el P. A medida que la disponibilidad de P en la solución del suelo se va agotando, es reabastecido desde fracciones lábiles (tanto orgánicas como inorgánicas) que están en equilibrio con formas menos disponibles (constituyentes primarios del suelo). El mayor grado de retención de fosfatos se presenta en suelos más arcillosos, pero el P es progresivamente liberado a formas lábiles y a la solución del suelo, es decir pasa a ser biodisponible. El abastecimiento de P del fertilizante más allá de un ciclo de producción es lo que se denomina “residualidad de la fertilización” y permite el manejo del P a nivel de secuencias de cultivos. La recuperación del P aplicado es relativamente baja, del orden del 20%, dependiendo del tipo de suelo y condiciones edáficas. A diferencia de la retención de fosfatos en suelos, en la fijación de fosfatos, gran parte del P agregado como fertilizante pasa a formar estructuras químicas permanentes dentro de la fase sólida del suelo, quedando no disponible para los cultivos. Este mecanismo se presenta en suelos con mineralogía de arcillas predominantemente caolinítica (arcillas 1:1) o con elevados contenidos de óxidos y/o alofanos. Share on linkedin Share on google Share on email More Sharing ServicesCompartir Etiquetas: Fertilidad de Suelos y Nutrición VegetalSi te gustó esta entrada anímate a escribir un comentario o suscribirte al feed y obtener los artículos futuros en tu lector de feeds. Comentarios
Comentario by Sergio González Gonzál el 5 junio 2009 @ 11:45 Ing. Ibañez, buen trabajo, profundo y claro lo felicito. Tiene información para aplicar el fosforo via foliar, le agradecería su orientación. Nuevamente felicidades.Comentario by Juan Jose Ibez el 5 junio 2009 @ 11:56 Hola Sergio este post no es mio. Lo escribio Martín Torres Duggan de Argentina. Él solo escribe eventualmente y yo no soy experto en fertilidad. No deseo comentarte incorrectamente algunos aspectos debido a mi ignorancia. Permíteme pues que te indique que en Internet seguro que encuentras lo que buscas. Lo lamento de verdad.Un cordial saludoJuanjo IbáñezComentario by Ronald Jimenez el 5 diciembre 2009 @ 13:07 Buenas tardes, Dr. me gustaría saber ¿Que importancia tiene conocer el contenido de fósforo soluble en citrato de un fertilizante fosfatado de un fertilizante natural?Comentario by Yamileth el 27 enero 2010 @ 22:24 Buenas tardes Doctor. Quisiera me dijera ¿Que importancia tiene conocer el contenido de fósforo soluble en citrato de un fertilizante fosfatado de un fertilizante natural?Comentario by Régulo el 28 enero 2010 @ 23:58 El fosforo soluble en citrato es una forma de cuantificar el fosforo disponible para las plantas. Pero también es importante el tamaño de sus partículas y como estas pueden reaccionar con otros compuestos del suelo como los de Ca o Fe que lo pueden volver insoluble.Comentario by ALUMNO GTZ PEREZ CALLETANO el 18 agosto 2011 @ 21:50 buen trabajop me ayudo a realizar un trabajo de investigacionComentario by Ferreira, Dulce el 15 noviembre 2011 @ 15:34 Muy buen trabajo Dr., quisiera saber, hasta que grado el tipo de suelo y la textura influyen en la disponibilidad de P para las gramíneas en la fase de implantación.Comentario by Régulo León Arteta el 17 noviembre 2011 @ 23:37

Estimada Dulce respecto al tipo de suelo y su influenica en la disponibilidad tu pregunta es muy amplia y había que hablar de cada tipo de suelo. Para las textura gruesas la disponiblidad no solo de P sino tmebién de otros nutrimentos es baja. Pero para la finas no necesariamente son ricas en fósforo, aunque pueden lo ser porque retienen mas cationes y aniones.Comentario by david el 21 julio 2012 @ 1:23 no entendiLa urea, también llamada, carbamida, carbonildiamida, etc, es un compuesto químico cuya fórmula es CO (NH2)2. Urea es como se nomina al ácido carbónico de la diamida. Se trata de una sustancia nitrogenada que producen abundantes seres vivos, para eliminar el amoníaco de sus organismos, ya que es considerablemente tóxico. En los hombres y otros animales, se encuentra presente en sangre, hígado, linfa, sudor, órganos, huesos, etc., llegando a haber, por ejemplo, concentraciones de hasta 20g por litro en la orina de los humanos. Este compuesto químico se produce principalmente en el hígado, actuando como producto metabólico final. Su aspecto es el de un sólido cristalino, de color blanquecino. Su forma es la de una esfera o en ocasiones, también adopta una forma granular. Esta sustancia posee la capacidad de absorber agua atmosférica, es decir, es higroscópica, y suele relacionarse con un ligero olor característico a amoníaco. El nitrógeno que contiene la urea, llega a ser un 80% del nitrógeno presente en la orina, el cual proviene de la descomposición celular del cuerpo, aunque la mayor parte procede de las proteínas que ingerimos en nuestra alimentación. También existe presencia de urea en ciertos hongos, o en algunas partes de algunos cereales.La urea es fácilmente soluble tanto en agua como en alcohol, y algo soluble en éter. La urea fue la segunda sustancia de tipo orgánico en ser sintetizada de manera artificial, hecho realizado por el químico Friedrich Wöhler, en el año 1828. Hoy en día se obtiene a partir de la síntesis de Wöhler, en honor a su diseñador.La urea es una sustancia orgánica nada peligrosa, pues ni es tóxica, ni cancerígena, además de no ser inflamable, aunque en contacto directo con los ojos puede causar irritación. A pesar de esto, la urea mezclada con ciertos agentes reductores como el hipoclorito, puede producir gases inflamables y considerados tóxicos, como el amoniaco y el CO2.Las reacciones de la urea suelen tener lugar en termo descomposición, a una temperatura que ronda los 160ºC, produciendo, como ya se mencionó, gases de tipo inflamables como pueden ser el CO2, el cianato de amonio, etc. Si continuamos calentando la urea, llegaremos a la formación de compuestos cíclicos de ácido cinabrio.En la naturaleza, podemos hablar del ciclo de la urea. Dicho proceso consiste en la producción de urea partiendo como base del amoníaco, consumiendo energía. En los mamíferos, incluyendo el hombre, la urea es considerada como una sustancia de desecho, que viene producida cuando se ingieren proteínas. La urea viaja a través de la sangre, hacia los riñones, donde se filtrará y pasará a ser depositada en la orina. Un adulto elimina unos 28 gramos de urea al día.En la naturaleza, también encontramos la ureasa, una enzima producida por unas bacterias que se encuentran en el suelo. Esta enzima es de tipo hidrolítica, y cataliza las reacciones de descomposición de la urea que tienen lugar en el agua, dando la formación de anhídrido carbónico y amoniaco. Así observamos, que en la naturaleza se produce urea a través de diferentes reacciones, las cuales tienen lugar en ambos sentidos.La urea tiene diferentes usos y aplicaciones, como por ejemplo, su uso como fertilizante. Este uso es el mayoritario, pues un 90% de la urea que se produce, tiene dicho fin. Se utiliza para fertilizar suelos y plantas, a los cuales les provee del nitrógeno que necesitan. La urea como fertilizante es bastante ventajosa si la comparamos con otros fertilizantes, pues proporciona bastante nitrógeno, elemento esencial para las plantas.La urea también se utiliza ampliamente en la industria química, donde se usa en la fabricación de plásticos, tintas, adhesivos, medicinas, papel, etc. También ocupa un papel importante en la ganadería, donde se suele mezclar con el alimento para el ganado, dando un aporte de nitrógeno, vital para la formación de las proteínas de los animales.

Lee todo en: Química de la urea | La Guía de Química http://quimica.laguia2000.com/compuestos-quimicos/quimica-de-la-urea#ixzz2FDdKLNr3