Prédispositions génétiques au cancer colorectal: … · Prédispositions génétiques au cancer...
Transcript of Prédispositions génétiques au cancer colorectal: … · Prédispositions génétiques au cancer...
Prédispositions génétiques au cancer colorectal: aujourd’hui et demain
Pierre Hutter HUG/Genève; ICHV/Sion
ARL, Bourguillon, 30 septembre 2010
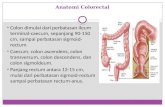
CIN PIK3CA KRAS PIK3CA TP53 SMAD4 (e.g., CDC4) BRAF PTEN BAX TGFBR2 APC
b-Catenin MMR
Progression du cancer colorectal
cas sporadiques: 25-35 ans (>120 gènes impliqués)
« agrégation familiale suggérant une composante héréditaire (selon les lois de Mendel) »
Paul Broca : 1824-1880 Chirurgien français
1849
Prédispositions génétiques au cancer: diagnostic prédictif
Agrégation familiale • variants à faible pénétrance
Syndromes héréditaires
• autosomal dominant • forte pénétrance • individus " à haut risque "
. . . . . . . . .
Syndromes de cancers héréditaires
19p STK11 Peutz-Jeghers 10q PTEN Maladie de Cowden 16q CDH1 Cancer gastrique familial
9p 12q
CDKN2 CDK4
Mélanome familial
3p VHL von Hippel-Lindau 10q RET Néoplasie endocrinienne multiple (MEN) 2 13q RB1 Rétinoblastome (rétine, os)
17p / 22q TP53 / CHEK2 Li-Fraumeni (sein, leucémie, sarcome) 5q / 1p APC / MUTYH Polypose adénomateuse familiale (FAP)
2p 3p
2p, 2q, 7p
MSH2 MLH1
MSH6, PMS1, PMS2
Syndrome de Lynch (Cancer colo-rectal sans polypose héréditaire ; HNPCC)
17q 13q
BRCA1 BRCA2 Cancer du sein/ovaire héréditaire
Chromosomes Gènes Syndromes
Processus altérés dans les cancers
……………
……………
……………
……………
Croissance Réparation Sénescence Division d’ADN Apoptose
Accélérateurs:
Proto-oncogènes Oncogènes Développement de cancer
Freins:
Activation
Suppresseurs de tumeurs
Perte de protection contre le cancer
Inactivation
Gènes suppresseurs de tumeurs mutés prédispositions au cancer
Première copie altérée dès la conception= prédisposition
« Longévité » de la deuxième copie?
Abolition de la fonction
2 3 1 MBP MBP
HDAC HDAC HDAC
2 3 1
HDAC HDAC MBP MBP
a. Cellule normale
b. Cellule tumorale
histone déacétylée
histone acétylée CpG non méthylé
CpG méthylé
n exon
X
site d’initiation de la transcription
HDAC: histone déacétylase MBP: methyl binding proteins
Méthylation de l’ADN et modification de la configuration de la chromatine d’un gène suppresseur de tumeur
MBP
Cancer Colorectal Héréditaire Sans Polypose (HNPCC) ou s. de Lynch
Différents organes sont affectés
Environ 1/800 dans la population générale porteur d’une mutation constitutionnelle
Le test génétique sauve des vies
TUMEURS s. Lynch « hors-côlon »
Endomètre Syst. hépatobiliaire Estomac Reins Ovaires Urètre Intestin grêle Pancréas Voies urin. sup. Peau
s. Lynch: risque cumulatif à 75 ans
Côlon et rectum H: 80-85 %
F: 40-60 %
Endomètre: 21-71 %
Ovaire: 10-12 % (souvent formes épithéliales endométroïdes et mucineuses)
hMLH1/hPMS2 PCNA
ATP ADP
MSH6
MSH6 MSH2
G T
5' 3'
5' 3'
MSH2 ADP ATP
G T
MLH1 PMS2
ATP ADP G
G C
5' 3'
5' 3'
DNA polymerase δ PCNA DNA ligase
3‘-5’ exonuclease DNA helicase (?)
G T
Deux types d’instabilité génétique dans les CCR familiaux
Instabilité de microsatellites (MSI) Côlon droit, indolent, diploïdie, mutations
dans TGFβRII et BAX
Instabilité chromosomique (CIN) Côlon gauche, agressif, aneuploïdie,
mutations dans APC,K-ras, PIK3CA, p53
s. Lynch
PAF
MICROSATELLITES CHEZ l’HOMME!
Répétitions de 1 - 5 paires de bases
Séries de ~ 6 - 30 unités répétées
Distribués à travers l’ensemble du génome
>100,000 microsatéllites dans notre génome
Une grande partie sont polymorphiques
Particularités cliniques âge moyen au diagnostic des cancers colorectaux
présence des critères d’Amsterdam présence de patient(s) avec cancer de l’endomètre
Probabilité de détecter une mutation MLH1 ou MSH2 forte
Recherche de mutations
faible
Analyses MSI/IHC
si résultat positif
Modèle de décision pour analyse de mutations MLH1 et MSH2
Critères d’Amsterdam II • Trois apparentés avec tumeurs de type s. de Lynch • Un apparenté au 1er degré aux 2 autres • Au moins 2 générations concernées • Au moins 1 ca diagn. avant 50 ans • Exclusion de polypose adénomateuse
Critères d’Amsterdam I/II
Directives de Bethesda II
IHC/MSI tests
Pas d’analyse des 4 gènes
Analyse des gènes MLH1, MSH2, MSH6, PMS2
+
+
+
-
-
-
IHC/MSI tests
Famille s. de Lynch
3 3 4
côlon - 57
côlon - 55
can. bil., 34 côlon, 31,51 estomac 33
poumon, 19 18
côlon, 32,51
côlon, 21,41 sein 41
17
20 21 22
49 côlon 35 caecum 40
côlon 41
47
côlon 39
+ = mutation confirmée
= mutation absente
Quatre mutations s. Lynch fondatrices en Suisse romande
• MLH1: 1 mutation non-sens en Valais (>plus de 300 ans d’âge)
• MLH1: 1 mutation faux-sens en Valais central (>200 ans d’âge)
• MLH1: 1 mutation d’épissage en Valais (>200 ans d’âge)
• MSH2: 1 grande délétion en amont affectant le promoteur, au canton de Vaud (>300 ans d’âge)
Syndrome de Lynch en Valais: MLH1
gène MLH1
85% de l’ensemble des mutations Lynch en Valais?
10%* 9% 24%* 42%*
: 3 mutations fondatrices (>250 ans) *
Conthey Bagnes Isérables Sierre
Episs. Insert. F. sens N. sens
Grandes délétions MSH2/MLH1
• Dans env. 10 % des familles AC+
• Dans > 40 % des familles AC+ sans mutation ponctuelle identifiée
• Points de ruptures souvent % rétro- transposons (séquences Alu …)
• Souvent des mutations fondatrices?
Sondes MLPA chaque exon de MLH1/MSH2
PCR primer sequence Y
Hybridization sequence
PCR primer sequence X
Stuffer sequence
(different for each probe) Hybridization sequence
Synthetic oligonucleotide 50-60 bp
M13-derived oligonucleotide 60-450 bp
Hybridisation & Ligation
1. The MLPA probemix is added to denatured genomic DNA 2. The two parts of each probe hybridize to adjacent target
sequences 3. Probes are ligated by a thermostable ligase
X
5’
5’ 3’ Target A
Y
Target B
5’
5’ 3’
Y
X
Amplification A universal primer pair is used to amplify all ligated probes The amplification product of each probe has a unique length
(130 - 480 bp)
1
2
3
45
Mutation ancestrale MSH2 du canton de Vaud: nouveau mécanisme de mutation!
EPCAM MSH2
allèle normal
méthylation allèle mutant
déletion 29 kb SA85 (Vaud)
IMPLICATIONS CLINIQUES
• Eviter des examens inutiles pour des individus non-porteurs d’une mutation
• Cibler la surveillance et la prévention sur les porteurs d’une mutation
S. de Lynch: recommandations de surveillance
1x / 1-2a 20-25 a Coloscopie
1x / 1-2a 30-35 a US rénal, cytologie urines *
1x / 1-2a 30-35 a Gastroscopie *
1x / a 30-35 a Ex. gynéco., US transvaginal, biopsie endomètre, Ca 125
Fréquence Dès Type
* si un parent atteint
Hétérogénéité des cancers colorectaux familiaux
Instabilité de microsatellites (MSI) Côlon droit, indolent, diploïdie, mutations
dans TGFβRII et BAX
Instabilité chromosomique (CIN) Côlon gauche, agressif, aneuploïdie,
mutations dans APC ,K-ras, p53, PIK3CA
s. Lynch
PAF
POLYPOSE ADENOMATEUSE FAMILIALE
• Incidence de mutations : ~ 1/8’000
• ~ 850 patients en Suisse
• Mutations germinales du gène APC
• Autosomal dominant, très forte pénétrance
• ≥ 25% mutations de novo
PAF : Clinique
• Développement de centaines -> 5 milliers de polypes adénomateux tout au long du tube digestif
– Âge moyen : 16 ans (5-38 ans)
– Â 35 ans : > 95% des patients ont des polypes
• Pas de colectomie : → ~ 100% Ca colorectal – Âge moyen : ~ 40 ans
PAF : spectre clinique
• Forme CLASSIQUE
• Forme ATTENUEE [“hereditary flat adenoma syndrome”]
< 100 adénomes; côlon proximal; Ca colorectal : 50-55 ans
• Syndrome de GARDNER PAF + ostéomes + tumeurs tissus mous (desmoïde)
• Syndrome de TURCOT Ca colorectal + Ca SNC (médulloblastome)
1889-1959 50a: Ca digestif
1889-1959 Ca estomac?
1918-68 50a: Ca côlon
1912-50 Ca côlon M+
1946- 1948- 35a: colectomie prophylactique
1974- 1980-
1910-85
1947- 34a: colectomie prophylactique
1950- 31a: colectomie prophylactique
1944- 38a: colectomie prophylactique
1942- 50a: colectomie prophylactique
1976- 22a:
Ca côlon
1973- 26a: colectomie prophylactique
1971- 25a: colectomie prophylactique
1938-
1967- 31a: colectomie prophylactique
1970- 26a: colectomie tumeur desmoïde
1882-1982 1882-1952
1908-62
1946- 1954-
APC : del ex 11-13 (spécifique/ CH)
Suppression tumorale par la protéine APC
APC+ GSK3-β
β-caténine
Destruction de la β-caténine
APC- Tcf et lef activés
Prolifération des cellules
Signal Wg-Wnt
Cycle cellulaire Myc activé
1 2 3 4 5 6 7 8 9 1011121314 15 EXON
FUNCTION Homodimerization
! ! Catenin-Binding and Downregulation Tubulin - Binding
Mild Classical
Catenin-Binding
Conductin Binding DLG-Binding
<177
POLYP PHENOTYPE
178-1249 Profuse 1250-1580
EXTRACOLONIC PHENOTYPE
CHRPE 463-1387
Desmoids 1403-1587
Corrélations Génotype/Phénotype
Mild >1580
APC
MUTYH: mutations bi-allèliques MAP
• 10-100 adénomes CR avec/sans cancer
• ~ 1 % de l’ensemble des CCR=MUTYH-/MUTYH-
• 7-8 % des patients FAP négatifs/APC
• cancer chez > 97% des porteurs à 60 ans
• mutations p.Y165C et p.G382D prédominent
GWAS et désert 8q24: 10 SNPs analysés sur 1.18 Mb
Cancer de la prostate: 1,854 cas et 1,894 contrôles
Cancer du sein: 2,270 cas et 2,280 contrôles
Cancer colorectal: 2,299 cas et 2,284 contrôles
Cancer de l’ovaire: 1,975 cas et 3,411 contrôles
Cancer de la vessie: 1,803 cas et 34,336 contrôles
POU5F1P1
C-MYC FAM84B
R1: Prostate
R5: Prostate R4:
Prostate
R2: Sein
R3: Pros- tate
Colon Ovaire
« Haplo-vue » de 1.18 Mégabases Centr. Télom.
10 SNPs en 8q24
600 Kb
R6: Vessie
6.1
SNP rs6983267
• situé dans 1,083 pb très conservées chez les vertébrés • très bon potentiel de fonction régulatrice
(UCSC browser) • contient un candidat d’amplificateur (vista enhancer track db)
Profil d’expression des gènesréseaux de co-expression
Correlation entre les niveaux de transcripts
Vue en trois dimensions de gènes co-exprimés
Activités de vastes réseaux de de gènes co-exprimés!
Deux éléments majeur d’un réseau:
Noeuds (cercles) = gènes (ou sondes sur une puce à ADN)
Lignes reliant les noeuds = correlations entre les niveaux d’expression de 2 gènes
Plus la distance entre 2 noeuds (gènes) est grande, plus faible est la corrélation entre les niveaux d’expression des 2 gènes
Propriété topologique d’un réseau de co-expression
Les gènes forment des groupes, correspondant à des “modules “
Chaque module représente un groupe de gènes fortement co-exprimés
Module turquoise
Module rouge
Dans chaque module certains gènes sont particulièrement corrélés entre eux “PIGNONS (HUBS)”
Les gènes des PIGNONS sont essentiels à la survie et à la croissance d’un organisme
Des variations de gènes des PIGNONS permettent de prédire l’évolution de tumeurs
PIGNON dans le module turquoise
PIGNON dans le module gris
APC
Méthlyl.
KRAS APC
Méthyl.
BRAF
MLH1
MSI
Méthyl.
P53
CIN
Cancer
Cancer
Cancer
côlon proximal assez bon pronostic, mauvaise réponse à
la thérapie adjuvante
mauvais pronostic, mauvaise réponse
au 5-Fu et au Cetuximab
cancer typique du côlon distal
Adénomes dentelés
Adénomes villeux
Adénomes tubuleux
Normal
Normal
Normal
10-20%
10-30%
50-70%