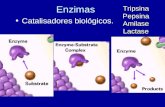
Enzimas -são catalisadores biológicos de alta especificidade. Catalisar uma reação química é...
-
Upload
ana-livia-santiago-farinha -
Category
Documents
-
view
216 -
download
0
Transcript of Enzimas -são catalisadores biológicos de alta especificidade. Catalisar uma reação química é...

Enzimas -são catalisadores biológicos de alta especificidade. Catalisar uma reação química é alterar a sua velocidade. A presença de enzimas nas reações celulares aumenta a velocidade da reação por serem altamente específicas.
Propriedades gerais das enzimas:
Velocidade das reações mais rápida - as reações catalisadas por enzimas são de 106 a 1012 vezes mais rápidas que as correspondentes não catalisadas.
Condições de reações mais brandas – as reações catalisadas por enzimas ocorrem em temperaturas inferiores a 100 C e pH quase neutro.
Maior especificidade da reação
Capacidade de regulação –
Introdução a Enzimas



Complementaridade geométrica. Em geral o sítio de ligação do substrato à enzimas consiste em um sulco na superfície da enzima, complementar ao formato do substrato.
Complementaridade eletrônica. Além disso, os resíduos de aminoácidos que formam o sítio de ligação estão organizados de modo a formar interações de atração específicas com o substrato.
A ligação do substrato na enzima se dá em uma pequena e bem definida região da enzima chamada de centro ativo (ou sítio ativo da enzima). O substrato deve ter a forma espacial adequada para se alojar-se no centro ativo da enzima. Com isto esta ligação permite uma especificidade para a catálise.
Especificidade dos substratos.

1- pH A maioria das enzimas apresentam um valor de pH para qual a atividade da enzima é máxima. A velocidade diminui a medida que o pH se afasta do valor ótimo, que é característico para cada enzima. Geralmente o pH é neutro.
2- Temperatura. A temperatura também interfere na atividade da enzima. Se aumentarmos muito a temperatura a enzima pode perder sua forma nativa que permite desempenhar sua função levando a um processo de desarranjo estrutural (perda da estrutura terciária) chamado de Desnaturação. A desnaturação provoca drásticas alterações conformacionais na molécula, acarretando na perda da catálise.Ex: acima de 50 a 55 C a maioria das proteínas globulares são desnaturadas.
3- Concentração do Substrato.
Os fatores que interferem na atividade enzimática:

Muitas enzimas necessitam de associação com co-fatores não protéicos
(moléculas ou íons) para exercer seu papel catalítico.
Os cofatores comumente encontrados incluem íons metálicos (Cu2+, Fe3+
ou Zn2+ etc) ou moléculas orgânicas, não protéicas, de complexidade
variada, que recebem o nome de coenzimas, tal com o NAD+.
As coenzimas são co-fatores que se assoxiam temporariamente com uma
dada molécula enzimática, de maneira que elas funcionam como co-
substratos.
Outros co-fatores são conhecidos como grupo prostéticos, que estão
permanentemente ligados a sua proteínas geralmente através de ligações
covalentes. Ex: heme o citrocromo c é fortemente ligado a proteína por uma
extensa rede de interações hidrofóbicas e pontes de hidrogênio junto a
ligações covalentes entre o heme e regiões específicas da proteínas.
Co-fatores:

O conjunto da enzima com o seu co-fator apropriado e cataliticamente
ativo é o chamado de holoenzima. A proteína enzimaticamente inativa
resultante da remoção do co-fator da holoenzima é chamada de
apoenzima; portanto a apoenzima é a porção protéica da holoenzima.
Apoenzima (inativa) + co-fator holoenzima (ativa)

INTERAÇÃO ENZIMA-SUBSTRATO
As enzimas aceleram a velocidade da reação por diminuir sua energia de ativação.
A velocidade das reações é explicada pela teoria das colisões. Esta teria
estabelece que, para a molécula reagir, as moléculas presentes em uma solução
devem colidir com orientação apropriada e que a colisão deve levá-las a adquirir
uma quantidade mínima de energia que lhes permita atingir o estado reativo,
chamado de estado de transição. Para levar todas as moléculas de um mol até
o estado de transição necessita uma quantidade de energia, chamada de energia
de ativação.
A energia de ativação é portanto a barreira que separa os reagentes do
produtos. A velocidade de uma reação será diretamente proporcional ao
número de moléculas com energia de ativação igual ou maior do que a
energia do estado de transição.


Cinética da reação enzimática.
A + B C+ B temos que v = k [A] [B]
O estudo das cinética das reações baseia-se na velocidade das reações,
que é diretamente proporcional a concentração do reagente. Como a
medida que se processa a reação a concentração do reagente diminui
e portanto a velocidade também, passando a ser proporcional a nova
concentração, estabeleceu-se a velocidade inicial (v0) proporcional a
concentração inicial de A.
A reação enzimática processa-se em duas etapas:
A enzima (E) e substrato (S) formam um complexo transitório (ES)
O produto é liberado (P) e a enzima volta na forma livre (E).

E + S ES P + EK1 K3
K2
V1 = k1 [E] [s]V2 = k2 [ES]V3 = k3 [ES]
Formação do complexo ES Formação da
dissociação do complexo ES
Formação do produto – etapa mais lenta e limitante
k1 > k2 > k3

Os pressupostos acima foram estabelecidos por Michaellis e Menten, que com tratamento matemático desvendaram a cinética de um grupo de enzimas chamadas de enzimas michaelianas.
As enzimas estão muito mais diluídas em solução do que o substrato e o números de moléculas de enzimas é muito inferior ao do substrato.

A análise das 3 situações de concentração diferentes de substrato na figura cima com o mesmo número de enzimas esclarece a influencia da concentração do substrato na velocidade da reação.
Com maiores concentração de substrato, as velocidades de formação do Produto é cada vez maior, porque estará formando cada vez mais complexo ES. E + S ES
75% 25% 50% 50% 25% 75% 0% 100%
Se a quantidade de substrato for muito grande, a quantidade, a
concentração de E será praticamente nula, encontrando-se toda a enzima
disponível sob a forma de ES.

Maior concentração possível do complexo ES é na situação onde
há formação de 100% e a reação será processada na maior
velocidade possível. Esta concentração é dita saturante e, a partir
dela novas concentrações de substrato não terá efeito sobre a
velocidade da reação, que atingiu seu valor máximo – Velocidade
máxima (Vmax). Assim a velocidade da reação é sempre
porpocional à concentração de ES.
A velocidade inicial é obtida medindo-se a quantidade
de produto formado em tempos suficientemente curtos para que
no máximo 5% do substrato tenha sido transformado em produto.

Constante de Michaelis (Km)
Km é a concentração do substrato na qual a velocidade da reação corresponde a metade da velocidade máxima. Portanto uma enzima que tiver o menor valor de Km, ela atingirá a máxima eficiência catalítica em baixas concentrações do substrato.
Ex: a hexoquinase pode aceitar a glicose ou a frutose como substrato. Mas o Km para a glicose é 0,15 mM e para a frutose é 1,5 mM. Isto significa que para a frutose ser substrato para a hexoquinase é necessário uma concentração de 10 vezes maior (1,5 mM) do que a glicose (0,15mM), portanto a hexoquinase tem uma maior afinidade pela glicose do que pela frutose
Equação de Michaelis – Menten
Vo = Vmáx [S] Km + [S]

1 = Km+ [S]v0 Vmax [S]
A Transformação da equação de Michaelis – Menten por Lineweaver-Burk facilitou a determinação do Km

Inibidores da atividade enzimática.
Inibidores Irreversíveis – são aqueles que reagem geralmente
através de ligações covalentes com as moléculas da enzimas,
destruindo-as parcialmente.
Um exemplo de inibidores irreversíveis é a penicilina seu inibidor liga-
se especificamente a enzimas da via de síntese da parede bacteriana,
inibindo-as, desprovidas de parede as células ficam sujeita a lise
bacteriana.

Inibidores reversíveis – são aqueles em que a inibição está relacionada com um equilíbrio entre enzima- inibidor. Podem ser competitivo e não competitivo.
Inibição competitiva ( Ic )- ocorre quando o inibidor e o substrato tem estruturas semelhantes entre si e competem pelo centro ativo da enzima. Neste caso a velocidade máxima permanecerá inalterada e o valor de Km (afinidade da enzima pelo substrato) será aumentada.
A velocidade máxima da reação será a mesma da reação efetuada sem a presença do inibidor, porem irá necessitar de uma maior concentração do substrato do que as reações sem a presença do inibidor, isto mostra que aparentemente há uma alteração no Km.

Inibição não competitiva (INC) - o inibidor combina-se reversivelmente com a molécula da enzima em um outro ponto da estrutura, que não seja o seu centro ativo. Estes inibidores não são semelhantes estruturalmente à molécula do substrato. Neste caso a velocidade será alterada e o valor de Km (afinidade da enzima pelo substrato) permanecerá inalterado. E + INC E - INC
. O valor de Km parece coincidir com o valor do novo km proporcionado pela diminuição da velocidade.


As enzimas alostéricas apresentam normalmente 2 centros ativos: um para o substrato a ser transformado e outro para um inibidor que regula sua atividade, daí o seu nome. Geralmente as enzimas alostéricas possuem estrutura quaternária, e não seguem a cinética de Michaelis-Menten, mostrando-se uma curva sigmóide.
Nas enzimas alostéricas, a ligação do substrato a um centro ativo pode afetar as propriedades dos outros centros ativos na mesma molécula de enzima. A atividade destas enzimas podem ser reguladas por inibidores, que se ligam a locais que não são os centros catalíticos.
Ex: A ligação do oxigênio à hemoglobina é afetada por H+ e CO2.
Inibição alostérica não obedecem à cinética de Mochaellis-Menten