CHEMISTRY
-
Upload
brendan-simpson -
Category
Documents
-
view
78 -
download
4
description
Transcript of CHEMISTRY










CHEMISTR
Y
FORLIFEBETTER

MAIN MENU
PENGARUH ION SENAMA
PENGENDAPAN

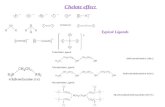
Ion sejenis adalah suatu ion yang ditambahkan kedalam larutan yang sudah mengandung sejumlah ion yang sama. Menurut azas Le Chatelier penambahan ion sejenis kedalam suatu larutan menyebabkan berkurangnya kelarutan suatu senyawa. Sering disebut Pengaruh Ion Sejenis (common ion effect).
PENGARUH ION SENAMA

Misalnya kita menambahkan AgNO3 atau Na2CrO4 kedalam Ag2CrO4.
Ag2CrO4 2 Ag+ + CrO4 2-
Dengan menambahkan menambahkan AgNO3 atau
Na2CrO4 maka akan memperbesar konsentrasi ion Ag+ dan CrO4 2- sehingga kesetimbangan bergeser ke sebelah kiri. Dan akibatnya, kelarutan zat tersebut menjadi berkurang.
PENGARUH ION SENAMA

Jadi pada intinya, dengan adanya penambahan pada ion sejenis maka akan memperkecil kelarutan suatu larutan elektrolit.
PENGARUH ION SENAMA

Harga Hasil Kali Kelarutan (Ksp) suatu larutan elektrolit dapat digunakan untuk memperkirakan apakah zat elektrolit itu dapat larut atau akan mengendap dalam suatu larutan. Akan ada tiga kemungkinan yaitu :
1. Ksp’ < Ksp2. Ksp’ = Ksp3. Ksp’ > Ksp
PENGENDAPAN

Hitunglah kelarutan PbI2 (Ksp = 1,6 x 10-8) dalam larutan Pb(NO3)2 0,1 M!
PENGARUH ION SENAMA

Ksp PbI2 = 4s3
s = 1,6 x 10-3
Pb(NO3)2 Pb2+ + 2 NO3-
0,1 M 0,1 M 0,2 MPbI2 Pb2+ + 2I-
0,1Ksp PbI2 = [Pb2+] [I-]2
s 0,1 s2
1.6 x 10-8 = s2 x 0,1s = 4 x 10-7
PENGARUH ION SENAMA

Jika dalam suatu larutan terkandung Pb(NO3)2 0,05 M dan HCl 0,05 M, dapatkah terjadi endapan PbCl2? (Ksp PbCl2 = 6,25 x 10-5)
PENGENDAPAN

Jawab:[Pb2+] = 0,05 M[Cl-] = 0,05 M[Pb2+] [Cl-]2 = 0,05 x (0,05)2
= 1,25 x 10-4
Oleh karena [Pb2+] [Cl-]2> Ksp PbCl2, maka PbCl2 dalam larutan itu akan mengendap.
PENGENDAPAN

SOAL

1. Jika diketahui Ksp AgCl pada suhu 25oC adalah 4 x 10-10, maka berapa kelarutan AgCl dalam air pada suhu yang sama dan dalam larutan NaCl 0,1 M?
SOAL

2. Jika diketahui hasil kali kelarutan AgCl dalam air adalah 4 x 10-10, maka berapa kelarutan AgCl dalam larutan NaCl 0,2 M?
SOAL

3. Jika diketahui hasil kali kelarutan AgCl dalam air adalah 4 x 10-10, maka berapa kelarutan Ag2CrO4 dalam larutan Ag2CrO4 0,2 M?
SOAL

4. Periksalah dengan suatu perhitungan, apakah terbentuk endapan Ca(OH)2 jika 10 mL larutan CaCl2 0,1 M dicampurkan dengan 10 mL larutan NaOH 0,01 M. (Ksp Ca(OH)2 = 8 x 10-6)
SOAL

5. Suatu larutan mengandung Pb(NO3)2,
Mn(NO3)2, dan Zn(NO3)2 masing masing 0,01 M. Pada larutan ini ditambahkan NaOH sehingga pH menjadi 8. berdasarkan data
Ksp Pb(OH)2 = 3 x 10-15
Ksp Mn(OH)2 = 5 x 10-14
Ksp Zn(OH)2 = 5 x 10-16
Tentukan Hidroksida yang mengendap!
SOAL

Thank’s for your attention
This powerpoint will be exited automaticallyExiting...