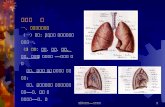
第二章 气相大气化学
description
Transcript of 第二章 气相大气化学

1
第二章 气相大气化学
基本要求
了解大气光化学反应基本原理,掌握氮氧化物主要气相反应, NO 、 NO2 和 O3 基本光化学循环、硫氧化物和有机物的主要气相反应。
掌握光化学烟雾形成条件和机理,了解平流层 O3 的生成和损耗的基本反应以及臭氧层破坏的基本原理。

2
第二章 气相大气化学大气光化学反应 分子或原子吸收光子 ---- 激发态分子(不稳定状态) ( 1 )碰撞消耗活化能返回基态; ( 2 )发生离解; ( 3 )直接与其他物质发生反应; ( 4 )发生荧光,回到基态。 大气辉光 O3 + H OH* +O2
OH* OH + h

3
氮氧化物气相反应
NO2+O 或 O3→NO3
NO3 可以和 NO 反应或光解作用再生成 NO2 或者再与 NO2 反应生成 N2O5 。 N2O5 与 H2O 作用形成 HNO3 。
NO 氧化为 NO2
NO + O3 NO2 + O2
NO 也可被自由基 OH 、 CH3O 、 CH3O2 和 CH3COO2 等氧化 OH + NO HONO
CH3O + NO CH3ONO

4
氮氧化物气相反应
CH3O2 + NO CH3O + NO2
CH3COO2 + NO CH3O + CO + NO2
RO2 + NO RO + NO2
NO2 与 OH 和 O3 等反应: OH + NO2 HNO3
O3 + NO2 NO3 + O2

5
氮氧化物气相反应
NO 、 NO2 和 O3 的基本光化学循环
当大气中 NO 与 NO2 和紫外线同时存在时, O3 可作为 NO2 光分解的产物而生成。
NO2 + h NO + O
O + O2 + M O3 + M
M 为空气中的 N2 、 O2 或其它第三者分子 O3 + NO NO2 + O2

6
二氧化硫气相反应1 、 SO2 与氧原子的反应 SO2 + O SO3
其中氧原子来源 NO2 光解 NO2 + h NO + O
O 原子的另一个反应: NO2 + O2 + M O3 + M + NO
2 、 SO2 与自由基反应 SO2 + HO2 OH + SO3
SO2 + CH3O2 CH3O + SO3
SO2 + HO HOSO2

7
有机物气相反应
一次大气污染物中有芳烃、氯化芳烃、烷烃、烯烃、羧酸类等。
二次大气有机污染物一般都含有 -COOH 、 -CH2OH 、 -CHO 、
-CH2ONO 、 -CH2ONO2 、 -COONO 、 -COONO2 、 -COOSO2 、
-COSO2 等基团。
大气气溶胶中可能含有约 20 个碳原子的羧酸类物质以及含约 15个碳原子的带硝基的羧酸类物质。

8
有机物气相反应 甲烷氧化作用 CH4 + O H3C +HO
H3C +O2 +M H3COO + M
CH4 + HO H3C +H2O
附加反应 H3COO + NO H3CO + NO2
H3CO + O3 多种产物
H3CO + O2 H2CO + HOO
H3COO +NO2 +M H3COO NO2 +M

9
有机物气相反应烷烃(卤代烃)、烯烃、醛、芳烃类化合物与 OH 反应 ( 1 ) OH 与烯烃反应 ( 2 ) OH 与烷烃反应 ( 3 ) OH 与醛类反应 ( 4 ) OH 与卤代烃反应 若卤代烃中有氢原子,则将发生下面的反应: XH + OH X + H2O
当大气中的 OH 足够多时,即可减少卤代烃对平流层臭氧的破坏,若用含 H 的氟代烃也可减少对臭氧层的影响。
( 5 ) OH 与芳烃的反应

10
有机物气相反应烯烃与臭氧、原子氧和氮氧化物的反应
( 1 )烯烃与 O3 反应 形成气溶胶的可能途径之一( 2 )烯烃与 O 反应
( 3 )烯烃与 NO 反应
大气中存在着 O3 与烯烃的反应产物双自由基 R-CH-O-O ,再与 O2 和 NO2 相继反应产生过氧乙酰酯类物质。

11
有机物气相反应 天然有机物转化
植物排放不饱和有机化合物受太阳照射激发而发生反应,生成颗粒物。
在非城市地区和远离交通要道的野外,植物排放有机化合物的光化学反应或非光化学反应的氧化作用可能是形成霾雾的原因之一。

12
光化学烟雾
大量的氮氧化物 (NO) 和挥发性有机化合物 (volatile organic compounds ,简称 VOCs) → 大气;
(强日光、低风速和低湿度等稳定的天气条件)→发生化学反应
---- 生成以臭氧为主,还包括醛类、过氧乙酰硝酸酯 (PAN) 、过氧化氢(H2O2) 和细粒子气溶胶等污染物的强氧化性气团。
----- 光化学烟雾
碳氢化合物 (HCs) 划分为甲烷 (CH4) 和非甲烷碳氢化合物 (NMHCs) 两类

13
光化学烟雾 --VOCs 来源
(汽油燃烧、生物质燃烧、溶剂挥发和其他过程) 某城市地区大气中 NMVOCs的种类和大气浓度

14
光化学烟雾 --VOCs 来源 天然源 --自然界生长的植物可以向大气中释放挥发性有机物
常见树种排放 NMHCs 的组成

15
光化学烟雾 --NO 来源
人为来源 --- 燃料燃烧 流动燃烧源,如汽车等交通工具的贡献约占 2/3 ,其他固定燃烧源
的贡献约占 1/3 ,主要包括钢铁厂和发电厂等工业源。 ---N2--高温 (2100℃)---被氧化成 NO。
天然源 ---闪电、土壤排放和大气中其他含 N化合物的转化。

16
光化学烟雾 --NO 来源
活性奇氮物种 --- 将 NO 及其大气氧化产物,用 NOy 表示。
除 NO 外, NOy 还包括 HNO3 、 HNO2 、 NO3 、 N2O5 、 HNO4 、R(CO)OONO2(PANs) 、 RONO2) 和 ROONO2 等。
HNO3 和 NO3- 气溶胶是大气中 NO 的主要归宿。
N03 自由基在夜间边界层中的混合比达 300ppt ,是对流层大气中重要的活性自由基。
N2O 和 NH3 不属于活性奇氮物种之列。

17
光化学烟雾 --VOCs—NO 体系光化学反应 光化学烟雾污染的出现和日变化规律

18
光化学烟雾 --烟雾箱模拟实验
烟雾箱模拟实验结果

19
光化学烟雾 -- 化学反应过程 大气中 VOCs—NO体系的主要化学反应过程

20
光化学烟雾 -- 形成条件
汽车尾气以及石油和煤燃烧废气 --- 污染源。 空气中氧化剂特别是 O3 也包括 PAN (过氧乙酰硝酸酯)及其他
化合物是烟雾形成的指标。 发生光化学烟雾还必须有烃类参加,烯烃特别能使烟雾形成,也必须有 NO参加, NO 是建立导致烟雾形成的起始光化学过程。
光化学烟雾水平:氧化剂过量 0.15ppm1 小时以上。
光化学烟雾形成条件 ( 1 )引起光化学反应的紫外线。 ( 2 )烃类特别是烯烃的存在能引起光化学烟雾。 ( 3 ) NO参加,导致形成烟雾起始的光化学反应。

21
光化学烟雾 -- 形成机理
碳氢化合物和氮氧化物相互作用过程
1 、污染空气中 NO2 光解是光化学烟雾形成的起始反应。2 、碳氢化合物, OH 、 O 等和 O3 氧化,导致醛、酮、醇、酸等产
物以及重要的中间产物—— RO2 、 HO2 、 RCO 等自由基生成。3 、过氧自由基引起 NO 向 NO2转化,导致 O3 和 PAN 等生成。

22
光化学烟雾 -- 化学动力学机理
1 、 NO2 - NO - O3 循环 2 、 O 与无机粒子反应 3 、 NO3 、 N2O5 、 HNO2 、 HNO3 化学 4 、 OH 与无机粒子反应 5 、自由基形成反应 6 、烃类氧化反应 7 、醛类氧化反应 8 、 NO 氧化反应 9 、自由基消除反应

23
光化学烟雾 光化学烟雾化学动力学机理类型( 1 )归纳机理( 2 )特定机理
光化学烟雾和还原烟雾 洛杉矶的光化学烟雾和伦敦烟雾,均称为“烟雾”。 伦敦烟雾是还原性混合物,故称为还原烟雾(????)。 洛杉矶烟雾是高浓度氧化剂混合物,因此称为氧化烟雾。 发生污染的根源差异: 伦敦烟雾由燃煤引起,洛杉矶烟雾由汽车排气引起。

24
光化学烟雾 -- 判断光化学烟雾生成基本方法
1.实际测量大气中臭氧的浓度 光化学烟雾 ---- 氧化剂过量 0.15ppm1小时以上为标准。
2.大气中 NO-N02-O3 的日变化规律 高 O3水平 --存在较大远距离输送或平流层输送,
NO 、 NO2 、 O3污染物的日变化不明显,需考虑水平和垂直方向 O3
的可能输送。 3.过氧酰基硝酸酯 (PANs) 的监测 PANs物种 --
过氧乙酰硝酸酯 (PAN)和过氧丙酰硝酸酯 (PPN)

25
平流层化学 全球性环境问题
污染物 -- 大气和水的作用 ---全球传播,扩散至平流层 ---导致对整个地球的生命支撑系统产生危害的重大环境问题。
平流层臭氧损耗 ---全球环境问题 .

26
平流层化学 -- 平流层物理特征 平流运动315 ~ 400nm---UV-A 280 ~ 315nm---UV-B
200 ~ 280nm---UV-C

27
平流层化学 -- 平流层的化学特征
平流层中最重要的化学组分: 臭氧 (03) 对流层: 10% 左右 O3 平流层: 90%以上 O3
( 15 ~ 35 km )
最大值: 约 20~ 25km --“臭氧层” 柱浓度表示法 ----地面到高空垂直柱中臭氧总层厚。
STP(标准温度和压力 )下, 10-5m厚的臭氧 -- (一个) D.U .

28
平流层化学 -- 平流层的化学特征
直接来自对流层的化合物分子称为源分子。 在平流层中以活性中间体存在的组分称为自由基。 (反应生成的)相对稳定的产物称为储库分子。

29
平流层化学 -- 平流层的化学特征
( 1 )奇氮物种 (NO) a. N2O :
N2O+h(≤315nm)N2+O(1D)
N2O+ O(1D)2NO
b. 超音速和亚音速飞机 --N0 ( 2 )奇氢物种 (HO) O3+ h(≤310nm) 02+O(1D)
CH4+ O(1D) OH +CH3
H2O+ O(1D) 2OH
H2+ O(1D) OH+H

30
平流层化学 -- 平流层的化学特征
( 3 )奇氯、奇溴物种 (C10, BrO ) CH3Cl+ h Cl+CH3
CFCl3+ h (175nm<<220nm) CFCl2+Cl
CFCl2+ h (175nm<<220nm) CFCl+Cl
O(1D)+CFnC14-n CFnC13-n +C1O
Halon :
CBrClF2+ h (175 nm<<220nm) CClF2+Br

31
平流层化学 -- 平流层的化学特征
平流层源分子的垂直分布示意图(背景平流层气溶胶 )

32
平流层化学 -- O3 在平流层的化学反应
切普曼 (Chapman) 机制描述 O3 生成和破坏的过程 O2 + h ( 240nm ) 2O
O + O2 + M O3
O3 + h ( 325nm ) O2 + O
O + O3 2O2
臭氧分裂由光化学驱动。
产物 -- 基态 / 激发态 O3 + h ( 325nm ) O2 + O
O3 + h ( 325nm ) O2 *+ O*

33
平流层化学 -- 臭氧损耗催化过程
( 1 )水蒸气的影响 平流层水蒸气,与激发态氧原子形成 H , OH 与 HO2 ,使 O3
损耗约 10%。
HO + O3 HO2 + O2
HO2 + O OH + O2
总反应: O + O3 2O2

34
平流层化学 -- 臭氧损耗催化过程
( 2 ) NO 催化作用 平流层 N2O(紫外线辐射)分解为 N2 和 O 。
约有 1%的 N2O 又与激发态氧原子结合,经氧化产生 NO 和
NO2 是造成 O3 损耗的重要过程,估计约占 O3总损耗量的 70%。
NO + O3 NO2 + O2
NO2 + O NO + O2
总反应: O + O3 2O2

35
平流层化学 -- 臭氧损耗催化过程
( 3 )天然或人为的氯、溴及其氧化物的催化作用 海洋生物 --CH3Cl
CH3Cl + h CH3 + Cl
人为源:制冷剂 CFCl3 + h CFCl2 + Cl
CF2Cl2 + h CF2Cl + Cl
光解产生 Cl 可破坏 O3
O + ClO Cl + O2
Cl + O3 ClO + O2
总反应: O + O3 2O2

36
平流层化学 -- 南极臭氧洞
英国 --南极Halley Bay观测站 -- 臭氧柱浓度 --年变化
臭氧洞被定义为臭氧的柱浓度小于 200 D.U.

37
平流层化学 -- 南极臭氧洞
南极臭氧损耗及大气温度的垂直分布

38
平流层化学 -- 南极臭氧洞
南极臭氧洞面积变化趋势

39
平流层化学 -- 南极臭氧洞
全球臭氧损耗情况

40
平流层化学 --南极臭氧洞产生原因
(初期)南极臭氧洞出现的解释: ( 1 )对流层低臭氧浓度的空气传输至平流层,稀释平流层臭氧浓度。 ( 2 )宇宙射线作用,高空生成氮氧化物。 ( 3 )人工合成的含氯和含溴的物质。
南极臭氧洞形成的物理因素 ( 1 )太阳活动周期 影响幅度: 1%~ 2% ( 2 )大尺度的空气运动
影响幅度: 6%~ 8 % 准两年振荡 氮氧化物

41
平流层化学 --南极臭氧洞产生原因
南极地区
( 1 )(温度低、干燥)硫化合物 -- 硫酸 南极平流层 -- 颗粒物
( 2 ) HNO3·3H2O颗粒、冰晶( 240~ 195K )

42
平流层化学 --南极臭氧洞产生原因
极地平流层云形成过程示意图 ((a)Ⅱ型; (b)I型 )

43
平流层化学 --南极臭氧洞产生原因
极地涡旋形成和 PSCs 表面化学反应

44
平流层化学 --南极臭氧洞产生原因
HCl 和 ClONO2--- 颗粒物表面的非均相反应
ClONO2(g) + HCl(s)C12(g) + HNO3(s)
ClONO2(g) + H2O(s) HOCl(g) + HNO3(s)
HOCl(g) + HCl(s) C12(g) + H2O(s)
N2O5(g) + H2O(s) 2HNO3(s)
N2O5(g) + HCl(s) ClNO2(g) + HNO3(s)

45
平流层化学 --南极臭氧洞产生原因
C12 和 HOCl( 紫外线 ) → 光解 (冬天南极的紫外线极少, C12 和 HOCl 的光解机会很小 )
春天→ C12 和 HOCl → 光解→原子氯→臭氧损耗
氯原子的催化过程→南极臭氧破坏的约 70 %, 氯原子和溴原子的协同机制→大约 20 %。
(更多 ) 太阳光→南极→温度上升 ( 气象条件发生变化 ) →南极涡旋逐渐消失 ( 臭氧浓度极低的空气传输到地球的其他中纬度和低纬度地区 →造成全球范围的臭氧浓度下降 )